1,3-Thiazolidin-4-carbonsäure
1,3-Thiazolidin-4-carbonsäure ist ein Thiazolidin-Derivat mit einem Carboxysubstituenten in α-Stellung zur Aminogruppe. Die Verbindung gehört somit zu den heterocyclischen sekundären α-Aminosäuren. Das Strukturelement der 1,3-Thiazolidin-4-carbonsäure findet man in einer Reihe von pharmazeutischen Wirkstoffen, insbesondere bei den Penicillinen
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
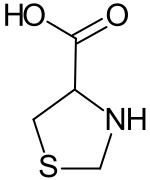 | ||||||||||||||||||||||
| Strukturformel ohne Angabe zur Stereochemie | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Name | 1,3-Thiazolidin-4-carbonsäure | |||||||||||||||||||||
| Andere Namen | ||||||||||||||||||||||
| Summenformel | C4H7NO2S | |||||||||||||||||||||
| Kurzbeschreibung |
farblose Nadeln[2] | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 133,17 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||||||||
| Schmelzpunkt |
196–197 °C (Zersetzung)[2] | |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||||||||
Synthese
Die Synthese von 1,3-Thiazolidin-4-carbonsäure wurde erstmals 1936 von Maxwell P. Schubert und unabhängig davon 1937 von Hans Thacher Clarke beschrieben.[4][2] Die Verbindung bildet sich bei der Umsetzung von Formaldehyd mit einer äquimolaren Menge Cystein in Salzsäure.[5] Nähere Untersuchungen zeigen, dass zunächst eine Addition von Formaldehyd an die Thiolgruppe erfolgt, mit anschließender Cyclisierung mit der Aminogruppe unter Wasserabspaltung.[2]
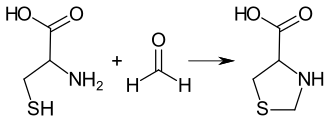
Stereochemie
1,3-Thiazolidin-4-carbonsäure ist eine chirale Verbindung mit zwei Enantiomeren.
| Isomere der 1,3-Thiazolidin-4-carbonsäure | ||
| Name | (4S)-1,3-Thiazolidin-4-carbonsäure | (4R)-1,3-Thiazolidin-4-carbonsäure |
| Andere Namen | D-Thiazolidin-4-carbonsäure | L-Thiazolidin-4-carbonsäure |
| Strukturformel | -1%252C3-Thiazolidine-4-carboxylic_acid.svg.png.webp) | -1%252C3-Thiazolidine-4-carboxylic_acid.svg.png.webp) |
| CAS-Nummer | 45521-09-3 | 34592-47-7 |
| 444-27-9 (DL) | ||
| EG-Nummer | 256-240-3 | 252-106-3 |
| 207-146-6 (DL) | ||
| ECHA-Infocard | 100.051.111 | 100.047.355 |
| 100.006.498 (DL) | ||
| PubChem | 198253 | 93176 |
| 9934 (DL) | ||
| DrugBank | – | DB02846 |
| DB12856 (DL) | ||
| Wikidata | Q27133347 | Q27093808 |
| Q23637400 (DL) | ||
Eigenschaften und Verwendung
1,3-Thiazolidin-4-carbonsäure besitzt hepatoprotektive (leberschützende), anticancerogene und Anti-Aging-Eigenschaften.[6] Die Verbindung wird unter der Bezeichnung TIMONACIC als Inhaltsstoff in kosmetischen Produkten zur Hautpflege eingesetzt.
Einzelnachweise
- Eintrag zu TIMONACIC in der CosIng-Datenbank der EU-Kommission, abgerufen am 11. August 2020.
- Sarah Ratner, H. T. Clarke: The Action of Formaldehyde upon Cysteine. In: Journal of the American Chemical Society. Band 59, Nr. 1, Januar 1937, S. 200, doi:10.1021/ja01280a050.
- Safety data sheet: Timonacic. (PDF) 24. Juli 2017, abgerufen am 11. August 2020 (englisch).
- Maxwell P. Schubert: Compounds of Thiol Acids with Aldehydes. In: Journal of Biological Chemistry. Band 114, 1936, S. 341 (PDF).
- Th. Wieland u. a.: Methoden zur Herstellung und Umwandlung von Aminosäuren und Derivaten. In: Eugen Müller (Hrsg.): Houben-Weyl - Methods of Organic Chemistry. 4. Auflage. Band XI/2. Thieme, Stuttgart 1958, S. 439 f. (eingeschränkte Vorschau in der Google-Buchsuche).
- Yat-Hing Ham, K. K. Jason Chan, Wan Chan: Thioproline Serves as an Efficient Antioxidant Protecting Human Cells from Oxidative Stress and Improves Cell Viability. In: Chemical Research in Toxicology. Band 33, Nr. 7, 20. Juli 2020, S. 1815, doi:10.1021/acs.chemrestox.0c00055.

