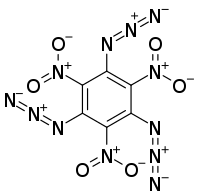
1,3,5-Triazido-2,4,6-trinitrobenzol
1,3,5-Triazido-2,4,6-trinitrobenzol ist eine aromatische, hochexplosive Verbindung, die zur Gruppe der organischen Nitroverbindungen und Azide zählt.
| Strukturformel | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||
| Allgemeines | |||||||||||||
| Name | 1,3,5-Triazido-2,4,6-trinitrobenzol | ||||||||||||
| Andere Namen |
| ||||||||||||
| Summenformel | C6N12O6 | ||||||||||||
| Kurzbeschreibung | |||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||
| |||||||||||||
| Eigenschaften | |||||||||||||
| Molare Masse | 336,14 g·mol−1 | ||||||||||||
| Aggregatzustand |
fest | ||||||||||||
| Dichte | |||||||||||||
| Schmelzpunkt | |||||||||||||
| Löslichkeit |
nahezu unlöslich in Wasser, schwach löslich in Alkoholen, gut löslich in Aceton und Benzol[1][2] | ||||||||||||
| Sicherheitshinweise | |||||||||||||
| |||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||
Gewinnung und Darstellung
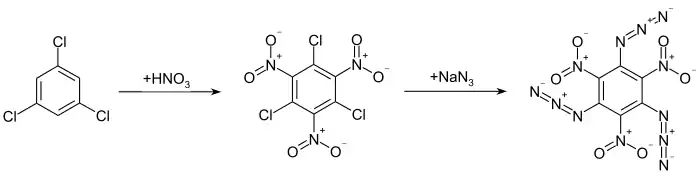
Die Synthese gelingt durch die Umsetzung von 1,3,5-Trichlor-2,4,6-trinitrobenzol mit Natriumazid.[1][2][4][5][6] Die Ausgangsverbindung kann durch die Nitrierung von 1,3,5-Trichlorbenzol mittels eines Gemischs aus Salpetersäure und rauchender Schwefelsäure als starkem Nitrierreagenz bei hohen Temperaturen hergestellt werden.[1][2][4][5] Bei einem zweiten Syntheseweg wird die Zielverbindung durch die Nitrierung von 1,3,5-Triazido-2,4-dinitrobenzol erhalten.[7]
Eigenschaften
Physikalische Eigenschaften
1,3,5-Triazido-2,4,6-trinitrobenzol ist ein kristalliner Feststoff, der bei 131 °C schmilzt.[8] Er kristallisiert in einem monoklinen Kristallgitter P 21/c.[7] Es handelt sich um eine stark endotherme Verbindung. Die Bildungswärme beträgt 765,8 kJ·mol−1, die Verbrennungswärme 3200 kJ·mol−1.[7]
Chemische Eigenschaften
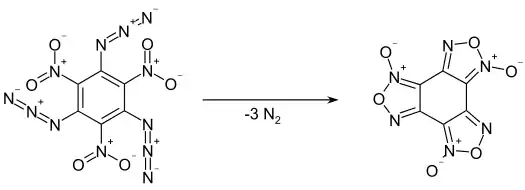
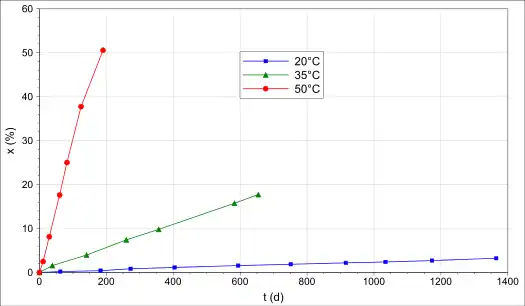
Die Verbindung zersetzt sich langsam auch schon bei niedrigen Temperaturen unter Abspaltung von Stickstoff zum Benzotrifuroxan. Die Umsetzung verläuft bei 100 °C innerhalb von 14 Stunden quantitativ. Bei 50 °C werden nach 190 Tagen ein Umsatz von 50 %, bei 35 °C nach 600 Tagen ein Umsatz von 16 % bzw. bei 20 °C nach 1200 Tagen ein Umsatz von etwa 2,8 % erreicht. Die Zersetzung verläuft nicht autokatalytisch.[1][2] In Lösung in m-Xylol wurde eine Zersetzung nach einem Zeitgesetz erster Ordnung beobachtet. Die Halbwertszeiten betragen dabei bei 70 °C 340 min, bei 85 °C 89 min und bei 100 °C 900 s.[9]
Die Verbindung kann sich explosionsartig zersetzen. Sie ist hochempfindlich gegenüber Schlag[10][7][11] und nur schwach empfindlich gegenüber Reibung[11].
| Sauerstoffbilanz | −28,6 %[10] |
| Stickstoffgehalt | 50,0 %[10] |
| Normalgasvolumen | 800 l·kg−1[10] |
| Explosionswärme | 5693 kJ·kg−1 (H2O (l))[10] |
| Spezifische Energie | 1666 kJ·kg−1 (68,1 mt/kg)[10] |
| Bleiblockausbauchung | 47,0 cm3·g−1[10] |
| Schlagempfindlichkeit | 5 Nm[10] |
Verwendung
1,3,5-Triazido-2,4,6-trinitrobenzol wurde als möglicher Ersatz des Initialsprengstoffes Quecksilberfulminat in Zündern, Sprengkapseln und ähnlichen gesehen.[12][13][14] Wegen der geringen thermischen Stabilität und somit Lagerstabilität konnte sich keine kommerzielle Anwendung durchsetzen.[15]
Literatur
- Robert Matyas, Jiri Pachman: Primary Explosives. Springer, 2013, ISBN 978-3-642-28435-9, S. 118–121.
Einzelnachweise
- O. Turek: Le 2,4,6-trinitro-1,3,5-triazido-benzene, nouvel explosif d’amorcage. In: Chimie et industrie. Band 26, 1931, S. 781–794.
- O. Turek: 1,3,5-Triazido-2,4,6-trinitrobenzen, nova inicialna vybusina. In: Chemicky obzor. Nr. 7, 1932, S. 76–79; 97–104.
- Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- Patent GB298981: A method of producing 2,4,6-trinitro-1,3,5-triazidobenzene. Veröffentlicht am 1928, Erfinder: O. Turek.
- Patent DE498050: Verfahren zur Herstellung von 1,3,5-Trinitro-2,4,6-triazidobenzol. Veröffentlicht am 1930, Erfinder: O. Turek.
- A.S. Bailey, J.R. Case: 4:6-dinitrobenzofuroxan, nitrobenzodifuroxan and benzotrifuroxan: A new series of complex-forming reagents for aromatic hydrocarbons in Tetrahedron 3 (1958) 113–131, doi:10.1016/0040-4020(58)80003-4.
- David Adam, Konstantin Karaghiosoff, Thomas M. Klapötke, Gerhard Holl, Manfred Kaiser: Triazidotrinitro Benzene: 1,3,5-(N3)3-2,4,6-(NO2)3C6. In: Propellants, Explosives, Pyrotechnics. Band 27, Nr. 1, 2002, S. 7–11, doi:10.1002/1521-4087(200203)27:1<7::AID-PREP7>3.0.CO;2-J.
- Yu M. Burov, G. M. Nazin, G. B. Manelis: Retardation of monomolecular reactions in the solid phase. In: Russian Chemical Bulletin. Band 48, Nr. 7, Juli 1999, S. 1250–1254, doi:10.1007/BF02495284.
- B. L. Korsunskii, T. A. Apina: Kinetics of the thermal decomposition of 1,3,5-triazido-2,4,6-trinitrobenzene in solution. In: Bulletin of the Academy of Sciences of the USSR, Division of chemical science. Band 20, Nr. 9, September 1971, S. 1971–1973, doi:10.1007/BF00854439.
- J. Köhler, R. Meyer, A. Homburg: Explosivstoffe. 10., vollständig überarbeitete Auflage, Wiley-VCH, Weinheim 2008, S. 324, ISBN 978-3-527-32009-7.
- B. T. Fedoroff, O. E. Sheffield, S. M. Kaye: Encyclopedia of Explosives and Related Items. Picatinny Arsenal, New Jersey (1960–1983).
- Patent GB298629: Improvements in and connected with explosive charges for detonators, percussion caps, boosters, detonating fuses, projectiles and the like. Veröffentlicht am 1927, Erfinder: O. Turek.
- Patent DE494289: Verfahren zur Herstellung von Sprengladungen für Sprengkapseln, Zündkapseln, Detonationszündschnüre u. dgl. Veröffentlicht am 1928, Erfinder: O. Turek.
- Patent US2111719: Ignition mixture for percussion caps of all kind, small munitions, and primers. Veröffentlicht am 1938, Erfinder: B. Zielinski.
- T. Urbanski: Chemistry and Technology of Explosives. PWN—Polish Scientific Publisher, Warschau 1967.