Voltameter
Ein Voltameter ist ein historisches Messgerät zum Messen der elektrischen Ladung (Elektrizitätsmenge). Ein alternativer Name ist Coulometer oder Coulombmeter. Es wurde in Form des Edisonzählers zur Messung der bezogenen Elektrizitätsmenge in den ersten Stromnetzen verwendet. Außer im Ausbildungsbereich und zu Demonstrationszwecken besitzt es keine praktische Bedeutung mehr. Es ist nicht mit einem Spannungsmessgerät, umgangssprachlich als Voltmeter bezeichnet, zu verwechseln.

Der Begriff entstand aus einer Bezeichnung von Michael Faraday, welcher diesen Messapparat als „volta-electrometer“ bezeichnet. In Folge nannte John Frederic Daniell den Aufbau „Voltameter“.[1]
Vom Prinzip her stellt das Voltameter ein über die Zeit summierendes Strommessgerät dar. Die SI-Einheit für die elektrische Ladung ist das Coulomb.
Arten
Ein Voltameter ist eine Elektrolysezelle, in der durch den elektrischen Strom eine chemische Umsetzung erfolgt, z. B. eine Gasentwicklung oder eine Metallabscheidung. Die eigentliche Messung erfolgt dann je nach Coulometertyp durch
- Wiegen des chemischen Elements, das in einer bestimmten Zeit an einer der Elektroden abgelagert oder freigesetzt wird, oder
- durch Volumenmessung des Gases oder
- durch Titration.
Metallvoltameter
Ein Metall wird elektrisch aufgelöst und wieder abgeschieden, und durch Wiegen der getrockneten Elektroden kann die Ladung bestimmt werden. Zumeist wurde das an der negativen Elektrode, der Kathode, abgeschiedene Metall gewogen. Da die Elektrode für die Wägung in der Regel entnommen und getrocknet wurde, arbeiteten diese Geräte diskontinuierlich.
Silbervoltameter
Das Silbercoulometer ist die genaueste Bauart. Es besteht aus zwei Silberplatten in einer Lösung aus Silbernitrat. Wenn Strom fließt, löst sich Silber an der Anode und schlägt sich an der Kathode nieder. Die Kathode wird gewogen, der Strom fließt in einer abgemessenen Zeit, dann wird die Kathode wieder gewogen usw. Das Silbercoulometer ist deswegen historisch besonders bedeutsam, da es bis 1948 als offizieller Primärstandard für die Messung der Stromstärke diente.
Kupfervoltameter
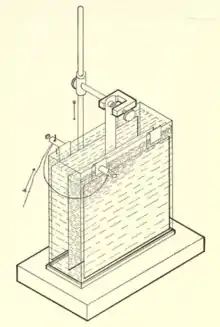
Das Kupfercoulometer ist dem Silbervoltameter ähnlich, aber die Anode und Kathode sind aus Kupfer und die Lösung ist Kupfersulfat, gelöst in Schwefelsäure. Es ist billiger als das Silbervoltameter, aber etwas weniger genau.
Zinkvoltameter
Zinkvoltameter gingen in die Geschichte der Elektrizität ein als die ersten beim Kunden installierte Strommessgeräte: Thomas Alva Edison verwendet sie ab 1881 zur Strommessung, und ließ ab 1883 die Stromrechnungen der Kunden seines Gleichstromnetzes damit erstellen. Zur Verbesserung der Genauigkeit und zur Kontrolle wurden zwei Zinkzellen in Reihe geschaltet, diese wiederum waren nicht im Hauptstromkreis, sondern parallel zu einem Messwiderstand (Shunt) im Hauptstromkreis geschaltet.
Quecksilbervoltameter
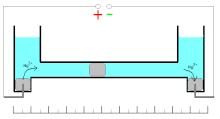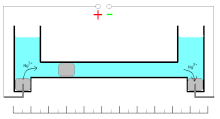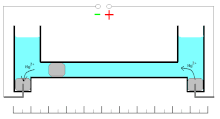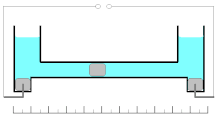
Bei dem Quecksilbercoulometer ist auch eine Volumenmessung möglich. Eine besondere Ausführung nutzt dabei einen verschiebbaren Quecksilbertropfen, was im Bereich der ersten Betriebsstundenzähler wie dem Edisonzähler zur Messung der bezogenen Elektrizitätsmenge genutzt wurde.
Gascoulometer
In diesen wurde Wasser elektrolysiert, wobei in der Regel verdünnte Schwefelsäure als Elektrolyt verwendet wurde. Daher werden diese Coulometer auch Schwefelsäurevoltameter genannt. Anode und Kathode sind bevorzugt aus dem korrosionsstabilen Platin. Bei der Elektrolyse entstehen an Wasserstoff an der Kathode und Sauerstoff an der Anode. Die beiden Gase wurden im Knallgasvoltameter als Gemisch in einem Messglas gesammelt. Im Hofmann-Voltameter oder Hofmannschen Wasserzersetzungsapparat werden die beiden Gase getrennt aufgefangen.
Da das Gasvolumen von der Temperatur abhängt, waren genauere Geräte mit einem Thermometer ausgestattet, und das Volumen wurde auf Standardbedingungen umgerechnet. Da Volumenmessungen weniger genau sind als Massenbestimmungen mit einer Präzisionswaage, waren Gascoulometer auch weniger präzise als Metallcoulometer. Der große Vorteil der Volumenmessung ist aber, dass keine Elektrode ausgebaut werden muss, so dass eine quasi kontinuierliche Messung möglich ist.
Weitere Bauformen
Eine weitere Bauform stellt das Iodcoulometer dar, bei dem die an der Anode entstandene Menge an Iod durch Titration der Lösung bestimmt wurde.
Ladungsberechnung mit Hilfe des elektrochemischen Äquivalents
Nach den Faradayschen Gesetzen ist die Ladung Q den umgesetzten Massen proportional, und es gilt:
- Q: übertragene elektrische Ladung, die bestimmt werden soll
- Δm: Massenänderung der Anode oder Kathode bei Metallelektroden, ermittelt mit einer möglichst genauen Waage, oder der Gasmenge bei Gascoulometern, die aus dem Gasvolumen und der Gasdichte berechnet wird
- z: Anzahl übertragener Elektronen pro Teilchen, Wertigkeit des Elements. Für Ag/Ag+ ist z = 1, für Cu/Cu2+ und Zn/Zn2+ ist z = 2
- F: Faraday-Konstante (≈ 96.485,3 As·mol−1)
- M: molare Masse. Für Silber: M = 107,8682 g/mol, für Kupfer: M = 63,546 g/mol.
- Äe: elektrochemisches Äquivalent, Äe = M/z F. Das elektrochemische Äquivalent eines Elements ist die Masse dieses Elements (in Gramm oder Milligramm), das von 1 Coulomb Elektrizität transportiert wird.
| Element | Ordnungszahl | Molmasse in g/mol | Wertigkeit | Äe in mg/As | Äe in g/Ah |
|---|---|---|---|---|---|
| Kupfer | 29 | 63,546 | 2 | 0,3293 | 1,1855 |
| Sauerstoff | 8 | 15,9994 | 2 | 0,0829 | 0,2985 |
| Silber | 47 | 107,8682 | 1 | 1,1180 | 4,0247 |
| Wasserstoff | 1 | 1,00794 | 1 | 0,0104 | 0,0376 |
| Zink | 30 | 65,409 | 2 | 0,3390 | 1,2202 |
Weitere Ladungsmessgeräte
Die Messung der elektrischen Ladung kann mit geringerem messtechnischen Aufwand durch elektronische Schaltungen wie den Ladungsverstärker erfolgen. Dieser liefert eine der elektrischen Ladungsmenge proportionale elektrische Spannung.
Literatur
- W. E. Ayrton und T. Mather,: Practical Electricity. Cassell and Company, London 1911, S. 12–26.
- John Ellis Myers: Ueber das Silber-Voltameter und Ueber das Faraday'sche Gesetz bei Strö̈men von Reibungselectricität. Buchdruckerei C. Gœller, Strassburg i. E. 1895 (archive.org).
Weblinks
Quellen
- Frank A. J. L. James: The correspondence of Michael Faraday, 1991, IET, ISBN 0863412491, letter 872, 9/1/1836