Silbercoulometer
Das Silbercoulometer ist ein historisches Gerät, mit dessen Hilfe elektrische Ladungen und konstante Stromstärken im Gleichstromkreis bestimmt wurden. Es hatte über ein halbes Jahrhundert lang eine hohe Bedeutung für Präzisionsmessungen von Ladung und der Stromstärke, insbesondere wurde es auch zur Definition dieser Größen und zur Bestimmung der Faradaykonstanten benutzt. Wie alle Coulometer hat es heute kaum mehr eine praktische Bedeutung, es wird aber noch für Schulungszwecke verwendet.
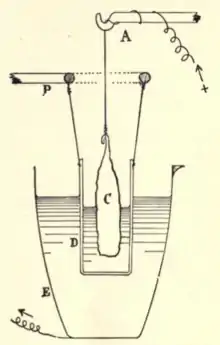
Das Silbercoulometer enthält eine Silbersalzlösung, die durch den Strom elektrolysiert wird. Die positive Elektrode besteht aus Silber, das durch die Elektrolyse in Lösung geht. An der negativen Elektrode wird Silber abgeschieden. Durch eine genaue Bestimmung der Massenänderung einer der Elektroden kann die Ladung berechnet werden, die durch das Gerät geflossen ist. Bei konstanter Stromstärke kann diese aus der bekannten Elektrolysedauer berechnet werden.
Historisches
Das Silbercoulometer, früher auch Silbervoltameter genannt, wurde erstmals 1861 von Johann Christian Poggendorff erwähnt[1]. Die Brüder Friedrich und Wilhelm Kohlrausch verwendeten ab 1881 verschiedene Silbercoulometer für Präzisionsmessungen, auch eines, bei dem sowohl die Kathode als auch die Anode aus Silber bestanden[2]. 1881 wurde auf einer internationalen Konferenz in Paris die Einheit der Stromstärke, das Ampere zwar einerseits über die Spannung von einem Volt und einen Widerstand von einem Ohm definiert, aber andererseits wurde auch festgehalten, dass die praktische Bestimmung des Ampere mit Hilfe des Silbercoulometers erfolgte.[3] John William Strutt, 3. Baron Rayleigh, studierte das Silbercoulometer genau. Er verwendete Platingefäße als Kathoden und Silberanoden, die in Filterpapier eingeschlagen waren, so dass bei der Silberauflösung eventuell herabfallende Metallflitter aufgefangen wurden und so die Messung der Tiegelmasse nicht verfälschen konnten.
Auf internationalen Konferenzen 1893 in Chicago und 1908 in London wurde das Silbercoulometer als offizieller Primärstandard für die Messung von Stromstärke und damit auch zur Bestimmung der Ladung festgelegt.[4] Das elektrochemische Äquivalent von Silber wurde 1893 als 1,118 mg/C festgelegt. In Deutschland wurde das Ampere im Reichsgesetzblatt von 1898 über die Elektrolyse definiert.
1946 wurde eine neue Definition für die Einheit Ampere vorgeschlagen, die auf Kräften beruht, die durch die magnetische Wirkung des elektrischen Stromes hervorgerufen werden. Diese neue Festlegung wurde 1948 auf der neunten Generalkonferenz für Maß und Gewicht offiziell festgelegt. Damit war das Ampere nicht mehr basierend auf der chemischen Wirkung des Stroms definiert, und das Silbercoulometer hatte nicht mehr die besondere Stellung im System der Messeinheiten. Allerdings war es nach wie vor zur Bestimmung der Faraday-Konstanten im Gebrauch.[4]
Mit der Reform des Internationalen Einheitensystems 2019 wurden das Ampere und das Mol neu definiert, indem man der Elementarladung und der Avogadro-Konstante feste Werte zuwies. Seitdem hat auch die Faraday-Konstante einen exakten Wert.
Vorteile
Die Molmasse des Silbers ist um einen Faktor von etwa 1,7 höher als die des Kupfers. Außerdem wird für eine bestimmte Ladung beim Silber die doppelte Stoffmenge abgeschieden. Daher ist das elektrochemische Äquivalent des Silbers das 3,4fache des Kupfers. Auch aus diesem Grund ist eine Messung mit dem Silbercoulometer genauer als eine mit dem Kupfercoulometer, und es ist zur Messung kleinerer Ströme besser geeignet. Weitere Gründe sind, dass Kupfer in sauren Lösungen durch Luftsauerstoff gelöst werden kann, während beim edleren Silber eine solche Störung nicht möglich ist, und dass Kupfer an Luft leichter oxidiert. Auch durch eine unvollständige Reduktion des Kupfers kann das Kupfercoulometer zu kleine Werte liefern.
Varianten
Die wichtigsten Kathodenmaterialien waren Platin, das sich leicht auf Gewichtskonstanz ausglühen lässt, und Silber. Als das im Elektrolyten gelöste Silbersalz wurde zumeist Silbernitrat verwendet, zum Teil auch Silberperchlorat[5]. Die beiden Elektroden befanden sich entweder im selben Gefäß oder in zwei Bechern, die durch eine mit Elektrolyt gefüllte Brücke verbunden waren.
Oft wurde die Masse des an der Kathode abgeschiedenen Silbers zur Ladungsbestimmung verwendet, doch es wurden auch Silbercoulometer benutzt, bei denen stattdessen die an der Anode aufgelöste Silbermenge abgewogen wurde.[5]
Ladungsberechnung
Nach den Faradayschen Gesetzen ist die Ladung Q der Massenänderung proportional, und es gilt:
- Q: übertragene elektrische Ladung
- Δm: Masseänderung der Anode oder Kathode, ermittelt mit einer möglichst genauen Waage
- z: Anzahl übertragener Elektronen pro Teilchen. Für Ag/Ag+ ist z = 1.
- F: Faraday-Konstante (96 485,3 As·mol−1)
- M: molare Masse. Für Silber: M = 107,8682 g/mol.
- Äe: Elektrochemisches Äquivalent, Äe = M/z F. Für Silber: Äe = 1,118 mg/As.
Einzelnachweise
- E. B. Rosa, G. W. Vinal: The silver voltameter – Part I. First series of quantitative experiments. In: Bull. Bur. Std. Band 9, Nr. 2, 1913.
- F. Kohlrausch, W. Kohlrausch: Das electrochemische Aequivalent des Silbers; zugleich eine experimentelle Prüfung erdmagnetischer Intensitätsmessungen. In: Wiedemanns Annalen der Physik und Chemie. Neue Folge. Band 27, 1886, S. 1.
- history of the ampere
- A. Horsfield: The Faraday and Its Significance in Determining the Fundamental Constants. In: Precision Measurement and Fundamental Constants, Proceedings of the International Conference held at the National Bureau of Standards, Gaithersburg, MD, 3-7 August, 1970. 1971, S. 137.
- D. Norman Craig, James I. Hoffman, Catherine A. Law, Walter J. Hamer: Determination of the Value of the Faraday with a Silver-Perchloric Acid Coulometer. In: J. Res. Nato. Bur. Stand.(US). 64A, Nr. 5, 1960 (Online @ NIST).