Kupfercoulometer
Das Kupfercoulometer ist – wie alle Coulometer – ein historisches Gerät, mit dessen Hilfe elektrische Ladungen und konstante Stromstärken im Gleichstromkreis bestimmt wurden. Es wurde in der Zeit ab etwa 1880 bis nach der Mitte des 20. Jahrhunderts[1] häufig benutzt. Insbesondere wurden Kupfercoulometer für größere Stromstärken benutzt, für die die genaueren Silbercoulometer geeigneter Größe sehr teuer gewesen wären. Wie alle Coulometer hat das Kupfercoulometer heute kaum mehr eine praktische Bedeutung, es wird nur noch für Schulungszwecke verwendet.[2][3]
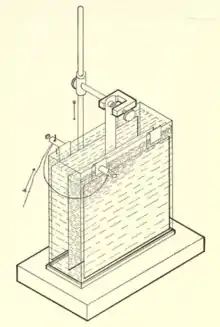
Das Kupfercoulometer enthält mindestens zwei Kupferbleche oder -platten als Elektroden, welche sich in einer leicht sauren Kupfer(II)-sulfat-Lösung befinden. Durch den Stromfluss durch die in Reihe geschaltete Zelle wird Kupfer an der positiven Kupferelektrode (Anode) aufgelöst und an der Kupfer-Kathode kommt es zur Abscheidung von Kupfer aus der Lösung. Aus den mit einer Waage ermittelten Massenänderung der getrockneten Kupferelektroden kann die Gesamtmenge an übertragener elektrische Ladung berechnet werden. Bei konstanter Stromstärke wird diese aus der bekannten Elektrolysedauer berechnet.
Der Elektrolyt bestand zumeist aus 150 g Kupfersulfat, 50 g Schwefelsäure, 50 g Ethanol und 1000 g Wasser.[4]
Historisches
Das Kupfercoulometer, im 19. Jahrhundert Kupfervoltameter genannt, war in Deutschland spätestens 1883[5] bekannt, in England spätestens 1886.[6] Die oben angegebene Elektrolytzusammensetzung wurde 1893 in einer Veröffentlichung von Felix Oettel empfohlen;[4][7] der Elektrolyt aus Kupfersulfat CuSO4, Schwefelsäure H2SO4, Ethanol C2H5OH und Wasser H2O wird daher auch Oettelsche Lösung genannt.[8]
Varianten
Als Kathode, auf der das Kupfer abgeschieden wurde, wurde für genauere Messungen auch Platinblech benutzt.[9] Insbesondere bei großen Strömen ist es vorteilhaft, ein Kathodenblech aus Edelstahl zu verwenden, da dieses das Gewicht des abgeschiedenen Kupfers besser tragen kann, und da es möglich ist, das abgeschiedene Kupfer vom Stahl abzuziehen und zusammengefaltet zu wiegen.[10]
Reaktionsgleichungen
- Anode (Pluspol, Oxidation)
- Kathode (Minuspol, Reduktion)
- Gesamtvorgang
Die Gesamtkonzentration der Lösung und die Gesamtmasse an Kupfer ändern sich nicht.
Ladungsberechnung
Nach den Faradayschen Gesetzen ist die Ladung Q der Massenänderung proportional, und es gilt:
- Q: übertragene elektrische Ladung
- Δm: Masseänderung der Kupfer-Kathode, ermittelt mit einer möglichst genauen Waage
- z: Anzahl übertragener Elektronen pro Teilchen. Für Cu/Cu2+ ist z = 2.
- F: Faraday-Konstante (≈ 96.485,3 As·mol−1)
- M: molare Masse. Für Kupfer: M = 63,546 g/mol.
- Äe: Elektrochemisches Äquivalent, Äe = M/z F. Für Kupfer: Äe = 0,3293 mg/As.
Einzelnachweise
- Gustav Kortüm: Lehrbuch der Elektrochemie. Verlag Chemie, Weinheim 1952.
- Uni Saarbrücken: Versuchsanleitung Leitfähigkeit von Elektrolyten (PDF; 501 kB)
- Uni Basel: Modul Elektrizitätslehre II, Faraday-Konstante (PDF; 106 kB), abgerufen 1. August 2016.
- A. K. Datta, N. Dhar: Accuracy of copper voltameters. In: Journal of the American Chemical Society. Band 38, Nr. 6, 1916, S. 1156–1160, doi:10.1021/ja02263a002.
- Hermann Hammerl: Studie über das Kupfervoltameter. In: Elektrotechnischer Verein Berlin (Hrsg.): Elektrotechnische Zeitschrift,. Band 4, Nr. 12. Julius Springer, Berlin 1883 (Internet Archive).
- Thomas Gray: On the Electrolysis of Silver and of Copper, and the Application of Electrolysis to the Standardizing of Electric Current- and Potential-meters. In: The London, Edinburgh and Dublin philosophical magazine and journal of science. Band 22, Nr. 138, 1886, S. 389–414 (Internet Archive).
- Felix Oettel: Chemiker-Zeitung. Band 17, 1893, S. 543, 577.
- Konrad Norden: Oettelsche Lösung. In: Viktor Engelhardt (Hrsg.): Elektrolytische Zähler (= Monographien über angewandte Elektrochemie. Band 31). Knapp, Halle a. S. 1908, OCLC 248771234, S. 37 (delibra.bg.polsl.pl [PDF]).
- Felix Auerbach: Strommessung. In: Adolph August Winkelmann (Hrsg.): Handbuch der Physik. 2. Auflage. Band 4. J. Barth, Leipzig 1905, S. 310 (Internet Archive).
- David Schlain, Charles B. Kenahan: A copper coulometer for use with large currents. In: Journal of Chemical Education. Band 35, Nr. 3, 1958, S. 144, doi:10.1021/ed035p144.