Vitellogenine
Vitellogenine (von lateinisch vitellum, „Dotter, Eidotter“) im Allgemeinen sind Proteine, die von Tieren als Vorläufer für Lipoproteine und Phosphoproteine produziert werden. Der Ort der Weiterverarbeitung ist unterschiedlich: in eierlegenden Wirbellosen und Wirbeltieren wird das sezernierte Vitellogenin durch Endozytose in die Eizellen eingebracht und mithilfe von Cathepsin D gespalten; die Teilproteine dienen als Reservestoffe für Lipide (Lipovitin) und Phosphat (Phosvitin); Letzteres ist in der Lage, weiteres Calcium und Eisen als Reserve für den Embryo zu komplexieren. Angeregt wird die Produktion von Vitellogenin durch Estrogene. Weitere Homologe des Vitellogenin finden sich in Tieren als Transportprotein für Triglyceride im Blut. Dazu zählt beispielsweise auch das Apolipoprotein-B-100 des Menschen. Mutationen im entsprechenden APOB-Gen können zu schweren erblichen Schäden im Fettstoffwechsel führen.[1][2][3][4]
Sowohl die Reservestoffe bei eierlegenden Tieren, als auch die genannten Transportproteine haben die Vitellogenin-Domäne gemeinsam, bestehend aus einer superhelikalen Domäne am N-terminalen Ende und mehreren großen offenen beta-Faltblättern.[5] Als Vitellogenine im engeren Sinn werden nur die Reservestoffe bei eierlegenden Tieren bezeichnet. Beim Haushuhn sind drei paraloge Gene bekannt, die für jeweils eine Isoform codieren. Vitellogenin-1 enthält 1850, Vitellogenin-2 1912 und Vitellogenin-3 347 Aminosäuren. Letzteres dient nur als Präkursor für Phosvitin. Der Fadenwurm Caenorhabditis elegans dagegen produziert sechs verschiedene Vitellogenin-Isoformen, die alle etwa 1600 Aminosäuren aufweisen.[6]
Verwendung als Estrogen-Test
Das Gen, das die Vitellogenin-Produktion steuert, ist auch bei männlichen Tieren vorhanden. Es wird nur von 17β-Östradiol und entsprechend wirksamen Substanzen aktiviert. Juvenile und männliche Tiere reagieren sehr sensibel, teils mit Geschlechtsumwandlung auf Zufuhr von Hormonen oder Stoffen mit analoger Wirkung wie DDT oder PCB.[7][8]
Der Vitellogenin-Test kann bei eierlegenden Tieren zum Nachweis der östrogenen Wirksamkeit einer Substanz verwendet werden. Dabei werden etwa männliche Fische eingesetzt und die Menge des produzierten Vitellogenins gemessen. Dies legt dann anhand des Vergleichs mit bekannten Substanzen die östrogene Wirksamkeit fest.[3][9]

Phosvitin im Eidotter
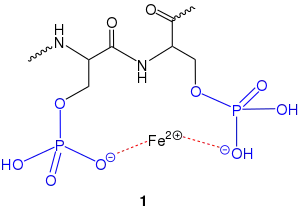
Die Bindung von Eisen in Eidottern von Hühnereiern erfolgt durch das Protein Phosvitin. Dieses enthält besonders viel von der Aminosäure Serin. Die Aminosäure-Sequenz wird aus reinen Blöcken von Phosphoserin-Resten (6–8 Reste) gebildet, die von gemischten Blöcken anderer Aminosäuren unterbrochen werden.[10] Die Hydroxygruppe im Serin ist häufig mit Phosphorsäure verestert. Die resultierende Verbindung wird als Phosphoserin 1 bezeichnet und enthält viele anionische Gruppen. Dadurch ermöglichen die Phosphoserin-Reste die Komplexierung von Eisen(2)-Ionen unter Bildung von 1. Wird ein Hühnerei zu lange gekocht, werden zunächst die Eisenionen aus 1 freigesetzt, dabei bleiben die veresterten Serineinheiten 2 zurück. Schließlich werden die Phosphorsäureester durch Verseifung vom Protein abgespalten, sodass die Serinblöcke 3 zurückgebildet werden. Außerdem entsteht Hydrogenphosphat.[11] Die Eisenionen diffundieren zur Grenzfläche zwischen Eidotter und Eiklar, wo sie zusammen mit Schwefelwasserstoff den charakteristischen, schwarzbraunen Rand bilden.
Einzelnachweise
- UniProt P55155, UniProt P87498, UniProt P04114
- PROSITE documentation PDOC51211. Vitellogenin domain profile. Swiss Institute of Bioinformatics (SIB), abgerufen am 14. August 2011 (englisch).
- Günter Fred Fuhrmann: Toxikologie für Naturwissenschaftler: Einführung in die theoretische und spezielle Toxikologie. Springer, 2006, ISBN 978-3-8351-0024-4, S. 343
- Hans-Hinrich Kaatz: Initiation und Regulation der Vitellogenin-Synthese bei der Bienenkönigin (Apis mellifica L.). Tübingen 1985, DNB 860721612 (Dissertation, Universität Tübingen).
- Interpro: Vitellogenin, superhelical, Vitellogenin, open beta-sheet
- UniProt P87498, UniProt P02845, UniProt Q91025
- Robert Guderian, Günter Gunkel: Handbuch der Umweltveränderungen und Ökotoxikologie. Bd. 3, Aquatische Systeme. Biogene Belastungsfaktoren – organische Stoffeinträge – Verhalten von Xenobiotika. Springer, 2000, ISBN 978-3-540-66188-7, S. 364ff
- André Leisewitz: Reproduktionsschäden und Umwelthormone – ein neues Umweltproblem? (PDF; 653 kB), 1996, Greenpeace e. V.
- Karl Höll, Andreas Grohmann: Wasser: Nutzung im Kreislauf, Hygiene, Analyse und Bewertung. 8. Auflage, Walter de Gruyter, 2002, ISBN 978-3-11-012931-1, S. 559
- Eintrag zu Phosvitin. In: Römpp Online. Georg Thieme Verlag, abgerufen am 4. Juni 2020.
- Roth, K.(2010): Chemische Köstlichkeiten. 1. Auflage, Weinheim: Wiley-VCH. S. 34f.