Vismodegib
Vismodegib ist ein Arzneistoff, der in der oralen Behandlung von Patienten mit fortgeschrittenem oder metastasiertem Basalzellkarzinom eingesetzt wird. Vismodegib ist der erste Vertreter der neuen Wirkstoffklasse („first-in-class“) der Hedgehog-Signalweg-Inhibitoren. Es wurde in dieser Indikation als Erivedge im Januar 2012 in den USA und im Juli 2013 in der EU zugelassen (Hersteller Roche).
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
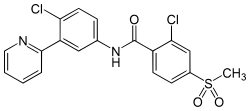 | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Freiname | Vismodegib | |||||||||||||||||||||
| Andere Namen |
2-Chlor-N-(4-chlor-3-pyridin-2-ylphenyl)-4-methylsulfonylbenzamid | |||||||||||||||||||||
| Summenformel | C19H14Cl2N2O3S | |||||||||||||||||||||
| Kurzbeschreibung |
weißer Feststoff[1] | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||||||||
| ATC-Code |
L01XX43 | |||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 421,3 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||||||
| Löslichkeit |
gut löslich in DMSO[1] | |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||||||||
Struktur und Eigenschaften
Vismodegib ist ein chloriertes Methylsulfonylbenzamid-Derivat und liegt als kristallines, nicht hygroskopisches, weißes bis bräunliches Pulver vor. Die Substanz ist der Klasse II gemäß dem biopharmazeutischen Klassifizierungssystem zuzuordnen. Vismodegib ist achiral und polymorph. Arzneilich verwendet wird die thermodynamisch stabile Modifikation B.
Vismodegib hat antitumorale Eigenschaften und ist oral wirksam. Es wird zur oralen Behandlung von Patienten mit fortgeschrittenem oder metastasiertem Basalzellkarzinom eingesetzt. Vismodegib ist fruchtschädigend und darf daher nicht bei schwangeren oder gebärfähigen Frauen angewandt werden. Da die Erkrankung (Basaliom) aber meist bei Menschen über dem 60. Lebensjahr auftritt, ist dies keine relevante Kontraindikation und betrifft vermutlich nur wenige Patienten.
Wirkungsmechanismus
Vismodegib wirkt über die Hemmung (Inhibition) des Hedgehog-Signaltransduktionsweges (Hedgehog-Signalweg, Hh-Signalweg). Dieser Signalweg spielt eine wichtige Rolle in der menschlichen Embryonalentwicklung, wo er das Zellwachstum und die Zelldifferenzierung steuert und infolgedessen die Größe und Ausdifferenzierung von Geweben. In den 1990er Jahren entdeckte man, dass bei Basalzellkarzinomen häufig eine abnorme Aktivierung des Hh-Signalwegs besteht, welcher bei Erwachsenen normalerweise inaktiv ist.
Vismodegib wirkt in der Hh-Signalkaskade, indem es spezifisch an den Transmembranrezeptor Smoothened (SMO), ein Schlüsselprotein des Hh-Signalwegs, bindet. Die Expression der Hh-Zielgene, von denen viele an der Proliferation, dem Überleben und der Differenzierung von Zellen beteiligt sind, wird unterdrückt.
Klinische Angaben
Anwendungsgebiete
Vismodegib wird angewendet bei erwachsenen Patienten mit:
- symptomatischem metastasierten Basalzellkarzinom
- lokal fortgeschrittenem Basalzellkarzinom, bei denen eine Operation oder Strahlentherapie nicht geeignet ist
Gegenanzeigen
- Überempfindlichkeit gegen den Wirkstoff
- Schwangere oder stillende Frauen; Frauen im gebärfähigen Alter, die sich nicht an das Erivedge Schwangerschaftsverhütungs-Programm halten
- Gleichzeitige Anwendung von Johanniskraut
Nebenwirkungen
Die häufigsten unerwünschten Arzneimittelwirkungen (UAW), die bei mehr als 30 % der Patienten aufgetreten sind, waren Muskelkrämpfe (74,6 %), Haarausfall (65,2 %), Geschmacksstörungen (57,2 %), Gewichtsverlust (48,6 %), Müdigkeit (44,9 %) und Übelkeit (34,8 %).
Frühe Nutzenbewertung in Deutschland
Seit 2011 müssen sich neu zugelassene Medikamente mit neuen Wirkstoffen in Deutschland aufgrund § 35a SGB V (AMNOG) einer „frühen Nutzenbewertung“ durch den Gemeinsamen Bundesausschuss (G-BA) unterziehen, wenn der pharmazeutische Hersteller einen höheren Verkaufspreis als nur den Festbetrag erzielen möchte. Nur wenn ein Zusatznutzen besteht, kann der Arzneimittelhersteller mit dem Spitzenverband der gesetzlichen Krankenkassen (GKV-Spitzenverband) einen Preis aushandeln. Dies gilt auch für Vismodegib. In einer ersten Bewertung hält das Institut für Qualität und Wirtschaftlichkeit im Gesundheitswesen (IQWiG) einen Zusatznutzen von Vismodegib für nicht belegt gegenüber der zweckmäßigen Vergleichstherapie.[3] Der G-BA traf im Februar 2014 den endgültigen Beschluss über das Ausmaß des Zusatznutzens, der die frühe Nutzenbewertung abschließt: „Patienten mit symptomatischem metastasierten Basalzellkarzinom: Ein Zusatznutzen ist nicht belegt; Patienten mit lokal fortgeschrittenem Basalzellkarzinom, für die weder eine Operation noch eine Strahlentherapie geeignet ist: Anhaltspunkt für einen geringen Zusatznutzen“.[4]
Literatur
- Zulassungsdokumentation zu Erivedge auf der Website der europäischen Arzneimittelagentur (EMA)
- Aleksandar Sekulic, Michael R. Migden, Anthony E. Oro, Luc Dirix, Karl D. Lewis, John D. Hainsworth, James A. Solomon, Simon Yoo, Sarah T. Arron, Philip A. Friedlander, Ellen Marmur, Charles M. Rudin, Anne Lynn S. Chang, Jennifer A. Low, Howard M. Mackey, Robert L. Yauch, Richard A. Graham, Josina C. Reddy, Axel Hauschild: Efficacy and Safety of Vismodegib in Advanced Basal-Cell Carcinoma. In: New England Journal of Medicine. 366, 2012, S. 2171–2179, doi:10.1056/NEJMoa1113713.
- John T. Lear: Oral Hedgehog-Pathway Inhibitors for Basal-Cell Carcinoma. In: New England Journal of Medicine. 366, 2012, S. 2225–2226, doi:10.1056/NEJMe1202170.
- B. M. Gensthaler, S. Siebenand: Neu auf dem Markt - Ponatinib und Vismodegib. In: Pharmazeutische Zeitung, Ausgabe 36/2013.
Einzelnachweise
- Vismodegib. (PDF) Sicherheitsdatenblatt, fluorochem.co.uk; abgerufen am 29. Dezember 2013.
- ERIVEDGE(R) Capsules (150 mg). (PDF) Sicherheitsdatenblatt, Roche; abgerufen am 29. Dezember 2013.
- Vismodegib bei Basalzellkarzinom: Zusatznutzen nicht belegt. Pressemitteilung des IQWiG, 17. Mai 2016, abgerufen am 1. März 2022.
- Nutzenbewertungsverfahren zum Wirkstoff Vismodegib. Beschluss des G-BA zur Nutzenbewertung nach § 35a SGB V, abgerufen am 6. Februar 2014.