Venetoclax
Venetoclax ist ein Arzneistoff für die Behandlung von Blutkrebs. Er ist der erste Vertreter der Wirkstoffklasse der Bcl-2-Hemmer und ist oral wirksam. Zulassungsinhaber ist in der EU die Firma AbbVie.
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
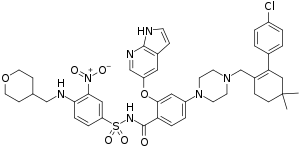 | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Freiname | Venetoclax | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C45H50ClN7O7S | ||||||||||||||||||
| Kurzbeschreibung |
Hell- bis dunkelgelber Feststoff[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Arzneistoffangaben | |||||||||||||||||||
| ATC-Code |
L01XX52 | ||||||||||||||||||
| Wirkstoffklasse |
Antineoplastika | ||||||||||||||||||
| Wirkmechanismus |
Inhibition von Bcl-2 | ||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 868,44 g·mol−1 | ||||||||||||||||||
| Löslichkeit |
Sehr niedrige Wasserlöslichkeit[1] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
Wirkungsmechanismus
Venetoclax hemmt selektiv das Protein Bcl-2 (B-cell lymphoma 2), das bei der chronischen lymphatischen Leukämie (CLL), beim Non-Hodgkin-Lymphom (NHL) und anderen B-Zell-Lymphomen überexprimiert wird.[3] Bcl-2 ist beteiligt an der Unterdrückung des natürlichen Vorgangs des programmierten Zelltods (Apoptose). Durch die Blockade von Bcl-2 wird die Signalkaskade wieder hergestellt, die Krebszellen dazu bringt, sich selbst zu zerstören.[1][4] Venetoclax vermag zudem die Unempfindlichkeit von Bcl-2-Proteinen gegenüber konventionellen Chemotherapeutika herabzusetzen, so dass solche besser wirksam werden können.[5]
Pharmakokinetik
Nach oraler Gabe treten maximale Plasmakonzentrationen nach 5 bis 7 Stunden auf. Venetoclax wird nahezu vollständig (über 99,9 %) an Plasmaproteine gebunden. Die Metabolisierung erfolgt hauptsächlich über CYP 3A4/3A5. Die Ausscheidung erfolgt zu über 99,9 % (davon 20,8 % unverändert als Venetoclax) über die Faeces.[1]
Die terminale Halbwertszeit beträgt circa 26 Stunden.
Anwendungsgebiete
Venetoclax ist in den USA seit April 2016 als Venclexta zugelassen zur oralen Therapie bei Patienten mit vorbehandelter (rezidivierter oder refraktärer) CLL mit Deletion von Chromosom 17p.[1][4] Die Zulassung erfolgte über ein beschleunigtes Verfahren („Break Through Therapy“). Eine Zulassung in der Europäischen Union wurde am 5. Dezember 2016 erteilt.[6]
Die Behandlung weiterer Formen von Blutkrebs wie indolentes Non-Hodgkin-Lymphom, diffuses großzelliges B-Zell-Lymphom (DLBCL) und akute myeloische Leukämie (AML) wird in Studien untersucht. Für die Behandlung der AML wurde Venetoclax in der EU der Status als Orphan-Arzneimittel zuerkannt.[5]
Zulassungsstudien
Studie M13-982: Basis für die Zulassung von Venclexta in den USA ist eine offene, einarmige, multizentrische Phase-II-Studie an 106 CLL-Patienten mit diagnostizierter 17p-Deletion, die zuvor bereits mindestens eine Therapie erhalten hatten. Die Studienteilnehmer erhielten einmal täglich eine Dosis Venetoclax, die ausgehend von 20 mg innerhalb von fünf Wochen auf 400 mg erhöht wurde. Primärer Endpunkt der Studie war die basierend auf den Richtlinien der National Cancer Institute-sponsored Working Group (in der durch den International Workshop for Chronic Lymphocytic Leukemia (IWCLL) aktualisierten Fassung) ermittelte Gesamtansprechrate. Ein unabhängiges Komitee stellte eine Gesamtansprechrate von 79,4 % fest.[3][7]
Nebenwirkungen
Als häufigste Nebenwirkungen wurden Neutropenie, Durchfall, Übelkeit, Infektionen der oberen Atemwege und Müdigkeit beobachtet.[1] Bei fünf Patienten wurde ein Tumorlyse-Syndrom (TLS) beobachtet, das jedoch bei keinem klinische Folgen hatte.
Siehe auch
- Navitoclax
- Obatoclax
Präparatenamen
Venclexta (USA), Venclyxto (EU)
Einzelnachweise
- VENCLEXTA (venetoclax) Tablets, for Oral Use. U.S. Full Prescribing Information. AbbVie Inc.. Abgerufen am 14. April 2016.
- Für diesen Stoff liegt noch keine harmonisierte Einstufung vor. Wiedergegeben ist eine von einer Selbsteinstufung durch Inverkehrbringer abgeleitete Kennzeichnung von 2-((1H-pyrrolo[2,3-b]pyridin-5-yl)oxy)-4-(4-((4'-chloro-5,5-dimethyl-3,4,5,6-tetrahydro-[1,1'-biphenyl]-2-yl)methyl)piperazin-1-yl)-N-((3-nitro-4-(((tetrahydro-2H-pyran-4-yl)methyl)amino)phenyl)sulfonyl)benzamide (amorphous) im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 10. Juli 2019.
- Roche Medienmitteilung: Entscheidende Phase-II-Studie mit Prüfmedikament Venetoclax erreichte primären Endpunkt bei schwer zu behandelnder Form von chronischer lymphatischer Leukämie, vom 12. August 2015.
- Leukämie: US-Zulassung für Venetoclax, Pharmazeutische Zeitung, Nachrichten, 13. April 2016.
- EU/3/16/1617
- EMA: An overview of Venclyxto and why it is authorised in the EU, 2018.
- Susanne Heinzl: CLL: Bislang nicht gesehene Ansprechraten mit Venetoclax bei Ultra-Hochrisikopatienten, Medscape, 14. Dezember 2015.