Varrentrapp-Reaktion
Die Varrentrapp-Reaktion, auch Varrentrapp-Abbau genannt, ist eine Namensreaktion der organischen Chemie. Sie wurde nach ihrem Entdecker Franz Varrentrapp benannt. 1840 wurde das erste Mal von dieser Reaktion berichtet.[1] Es handelt sich hierbei um den Abbau von ungesättigten Carbonsäuren mit Hilfe von Kalilauge zu Carbonsäuren mit zwei Kohlenstoff-Atomen weniger, Essigsäure und Wasserstoff.[2][3]
Übersichtsreaktion
Bei der Varrentrapp-Reaktion handelt es sich um den Abbau von ungesättigten Carbonsäuren. Die Reaktion ist sehr komplex, um die Übersichtlichkeit zu gewährleisten, wird sie im Folgenden verkürzt und vereinfacht skizziert.[2]
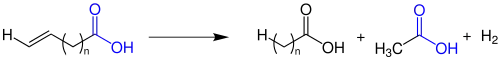
Bei nur einer Doppelbindung können Ausbeuten von bis zu 90 % erzielt werden.[2] Die Ausbeute hängt ansonsten von der Länge der Kohlenstoff-Kette und dem Ort der Doppelbindungen ab. Wenn die Doppelbindung in α,β-Stellung zur Carbonylgruppe liegt, dann läuft eher die retro-Claisenkondensation oder die retro-Aldolkondensation ab. Die Varrentrapp-Reaktion läuft nur bei sehr hohen Temperaturen (rund 300 °C) ab.[3]
Mechanismus
Der Mechanismus wird hier beispielhaft an (E)-4-Hexensäure gezeigt:[2]

Zunächst reagiert die Hydroxygruppe der Carbonylgruppe mit der Kalilauge 1, dabei bindet sich das Kalium-Atom anstelle des Wasserstoff-Atoms 2. Außerdem wird Wasser abgespalten, dies nennt sich Kondensation. Im nächsten Schritt wird wieder Wasser abgespalten und es bildet sich eine Verbindung mit zwei mersomeren Grenzformeln 3a und 3b. Nachdem noch einmal Wasser abgespalten wurde bildet sich eine Verbindung mit einer negativen Ladung am Kohlenstoff-Atom 4. Durch Umlagerungen bildet sich dann das Zwischenprodukt 5. Dieses reagiert dann wieder mit dem Hydroxid-Ion der Kalilauge und bildet über einen Zwischenschritt die Verbindung 6. Im darauffolgenden Schritt spaltet sich das Molekül 6 in zwei Teile, d. h. in Butanal 7 und das Carbanion 8. Das Anion 8 wird dann nur noch protoniert und bildet so Kaliumacetat (9). Butanal (7) reagiert dann mit einem Hydroxid-Ion. Anschließend wird molekularer Wasserstoff (H2) abgespalten, wobei sich das „verkürzte“ Buttersäure-Anion 10 bildet. Saure Aufarbeitung liefert dann die entsprechende Carbonsäure, im konkreten Beispiel Buttersäure.
Anwendung
Mit Hilfe dieser Reaktion können bestimmte Carbonsäuren aus ungesättigten Fettsäuren synthetisiert werden. Allerdings lohnt sie sich eher für industrielle Synthesen, da sie sehr komplex und aufwendig ist.[2][4]
Einzelnachweise
- F. Varrentrapp: Ueber die Oelsäure. In: Liebigs Ann. Chem. Band 35, 1840, S. 196–215, doi:10.1002/jlac.18400350205.
- Zerong Wang: Comprehensive Organic Name Reactions and Reagents. John Wiley & Sons, New Jersey 2009, ISBN 978-0-471-70450-8, S. 2864–2868.
- M. Windholz: The Merck Index. Merck & Co, Rahway 1976, ISBN 0-911910-26-3, S. ONR-90.
- H. F. Harwood: Reactions of the Hydrocarbon Chain of Fatty Acids. In: Chem. Rev. Band 62, 1962, S. 99–154, doi:10.1021/cr60216a002.