Triptycen
Triptycen gehört zur Klasse der aromatischen Kohlenwasserstoffe, deren Grundgerüst aus dem Barrelen besteht. Es ist das formale Produkt einer Diels-Alder-Reaktion von Anthracen mit 1,2-Didehydrobenzol, einem Arin. Die Verbindung besitzt eine Schaufelrad-Konfiguration mit D3h-Symmetrie. Das Kohlenwasserstoffgerüst ist äußerst rigide, so dass Triptycen und Triptycen-Derivate, wie beispielsweise Triptycenchinon,[3] in organischen Verbindungen als molekulares Gerüst in der Synthese bestimmter molekularer Motoren eingesetzt[4] oder als spezielle Ligandensysteme für zum Beispiel Hydrocyanierungsreaktionen[5] eingesetzt werden können.
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
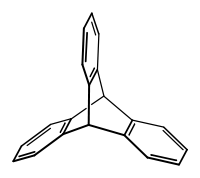 | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Triptycen | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C20H14 | ||||||||||||||||||
| Kurzbeschreibung |
Farblose Kristalle[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 254,33 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
Geschichte
Paul D. Bartlett und Mitarbeiter publizierten die Synthese 1942 und benannten sie nach „The triptych of antiquity“, übersetzt „Das Triptychon der Antike“, einem Buch bestehend aus drei an einer Achse zusammen befestigten Seiten.
Gewinnung und Darstellung
Die ursprüngliche Synthese des Triptycens verlief über sieben Stufen, beginnend mit Anthracen und p-Benzochinon. Im Labor lässt sich Triptycen aus Anthracen und Anthranilsäure herstellen. Dabei wird mittels Amylnitrit und Anthranilsäure das reaktive und kurzlebige Benzyn hergestellt, welches in situ mit Anthracen nach einer Diels-Alder-Reaktion am zentralen Benzolring des Anthracens zum Triptycen reagiert.
Einzelnachweise
- Eintrag zu Triptycen. In: Römpp Online. Georg Thieme Verlag, abgerufen am 30. September 2014.
- Datenblatt Triptycene, 98% bei Sigma-Aldrich, abgerufen am 27. Februar 2013 (PDF).
- Triptycene quinones in synthesis: preparation of triptycene bis-cyclopentenedione Spyros Spyroudis and Nikoletta Xanthopoulou Arkivoc 2003 (vi) 95–105 Online article (PDF; 186 kB).
- Kelly TR, De Silva H, Silva RA: Unidirectional rotary motion in a molecular system. In: Nature. 401, Nr. 6749, September 1999, S. 150–152. doi:10.1038/43639. PMID 10490021.
- Bini L, Müller C, Wilting J, von Chrzanowski L, Spek AL, Vogt D: Highly selective hydrocyanation of butadiene toward 3-pentenenitrile. In: J. Am. Chem. Soc.. 129, Nr. 42, Oktober 2007, S. 12622–12623. doi:10.1021/ja074922e. PMID 17902667. In dieser Reaktion ist das Substrat 1,3-Butadien, der Reaktionspartner Acetoncyanhydrin, der Katalysator Ni(cod)2 und der Ligand ein zweizähniges Organophosphin mit einem großen Griffwinkel auf einem Triptycengerüst.