Thiotepa
Thiotepa ist ein alkylierendes Zytostatikum, welches schon 1953 zur Behandlung von Krebserkrankungen (Brustkrebs, Blasenkrebs, Ovarialkarzinom) eingeführt wurde.[2] Es wird bis heute in der Onkologie verwendet.[3]
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
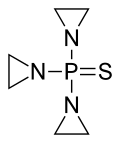 | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Freiname | Thiotepa | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C6H12N3PS | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Arzneistoffangaben | |||||||||||||||||||
| ATC-Code |
L01AC01 | ||||||||||||||||||
| Wirkstoffklasse | |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 189,22 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Toxikologische Daten | |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
2010 wurde Thiotepa EU-weit − in Kombination mit anderen Chemotherapeutika − zugelassen zur Vorbereitung von Patienten auf die Transplantation hämatopoetischer Stammzellen (HSZT) zur Behandlung bestimmter Erkrankungen des Blutes (z. B. Leukämie) sowie zur Behandlung solider Tumoren, wenn anschließend eine HSZT erfolgen soll (Handelsname TEPADINA®, pharmazeutischer Unternehmer ADIENNE Pharma & Biotech).[4]
Thiotepa wurde ursprünglich als Hilfssubstanz bei der Baumwollproduktion entwickelt.
Es ist ein kristallines, weißes Pulver mit einem Schmelzpunkt zwischen 54 und 57 Grad Celsius. In Lösungen ist Thiotepa nur wenige Tage stabil und muss entsprechend bei niedrigen Temperaturen gelagert werden.[1]
Im menschlichen und tierischen Organismus wird Thiotepa zum ebenfalls alkylierenden TEPA (Triethylenphosphorsäuretriamid) umgewandelt.
Die Anwendung von Thiotepa führt zu erheblichen Nebenwirkungen. Zu diesen gehören Anämien und eine krebserregende Wirkung, da Leukämien induziert werden können. Für Thiotepa ist auch eine Knochenmarktoxizität bekannt.
Einzelnachweise
- Datenblatt Thio-TEPA bei Sigma-Aldrich, abgerufen am 24. April 2011 (PDF).
- Sean M. Gallagher, Steven H. Selman: From the battlefield to the bladder: The development of thioTEPA. In: World Journal of Clinical Urology. Band 3, Nr. 3, 24. November 2014, S. 195–200, doi:10.5410/wjcu.v3.i3.195 (wjgnet.com [abgerufen am 31. Dezember 2018]).
- Tepadina® (thiotepa) – New Drug Approval. Abgerufen am 31. Dezember 2018.
- Informationen zu Tepadina auf der Website der europäischen Arzneimittelagentur.
Literatur
- Sykes, MP. et al. (1953): Clinical Studies of triethylenephosphoramide compounds with nitrogen mustard-like activity. Cancer 6(1); 142–48
- Maanen, MJ. et al. (2000): Chemistry, pharmacology and pharmacokinetics of N,N',N" -triethylenethiophosphoramide (ThioTEPA). Cancer Treat Rev. 26(4); 257–68; PMID 10913381
- Hagen, B. et al. (1990): Long-term pharmacokinetics of thio-TEPA, TEPA and total alkylating activity following i.v. bolus administration of thio-TEPA in ovarian cancer patients. Cancer Chemother Pharmacol. 25(4); 257–62; PMID 1688514