Thallium(III)-chlorid
Thallium(III)-chlorid ist eine anorganische chemische Verbindung des Thalliums aus der Gruppe der Chloride.
| Kristallstruktur | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
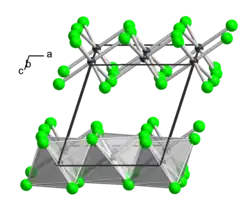 | ||||||||||||||||
| _ Tl3+ _ Cl− | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Thallium(III)-chlorid | |||||||||||||||
| Andere Namen |
Thalliumtrichlorid | |||||||||||||||
| Verhältnisformel | TlCl3 | |||||||||||||||
| Kurzbeschreibung |
farbloser Feststoff (Tetrahydrat)[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 310,74 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest[1] | |||||||||||||||
| Dichte | ||||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Gewinnung und Darstellung
Thallium(III)-chlorid-tetrahydrat kann durch Reaktion von Thallium(I)-chlorid mit Chlor und Wasser gewonnen werden.[3]
Das Hydrat lässt sich nur schwierig entwässern, ohne dass dabei Zersetzung zu Thallium(I)-chlorid eintritt. Es gelingt mit Thionylchlorid oder Phosgen in Gegenwart von etwa Chlor bei Zimmertemperatur.[3]
Direkt kann die Verbindung durch Reaktion von Thallium mit Nitrosylchlorid gewonnen werden, wobei eine Komplexverbindung TlCl3·NOCl entsteht, die bei niedrigem Druck das Nitrosylchlorid verliert.[3]
Eigenschaften
Thallium(III)-chlorid ist ein sehr hygroskopischer Feststoff, der in Wasser, Ethanol und Ether sehr leicht löslich ist. Bei etwa 140 °C beginnt ein Sinterungsprozess und bei 155 °C beginnt Zersetzung unter Chlorabgabe. Er besitzt eine monokline Kristallstruktur isotyp zu der von Aluminium(III)-chlorid (a = 654 pm, b = 1133 pm, c = 632 pm, β=110° 12').[3]
Das Tetrahydrat ist ein farbloser Feststoff, dessen Kristalle an feuchter Luft zerfließen. Seine Lösung reagiert infolge Hydrolyse stark sauer, bei starkem Verdünnen fällt braunes Thallium(III)-oxid-hydrat aus. Die Verbindung ist auch in Ethylalkohol und Ether leicht löslich.[3]
Verwendung
Lösungen von Thallium(III)-chlorid sind starke Oxidationsmittel und werden als solche in der organischen Chemie und Organometallchemie verwendet.[4]
Einzelnachweise
- Datenblatt Thallium(III) chloride tetrahydrate, 98% bei Sigma-Aldrich, abgerufen am 29. März 2014 (PDF).
- William M. Haynes: CRC Handbook of Chemistry and Physics, 93rd Edition. CRC Press, 2012, ISBN 1-4398-8049-2, S. 4–94 (eingeschränkte Vorschau in der Google-Buchsuche).
- Georg Brauer (Hrsg.), unter Mitarbeit von Marianne Baudler u. a.: Handbuch der Präparativen Anorganischen Chemie. 3., umgearbeitete Auflage. Band I, Ferdinand Enke, Stuttgart 1975, ISBN 3-432-02328-6, S. 877.
- A.J. Downs: Chemistry of Aluminium, Gallium, Indium, and Thallium. Springer, 1993, ISBN 0-7514-0103-X, S. 137 (eingeschränkte Vorschau in der Google-Buchsuche).


