Kornblum-Oxidation
Als Kornblum-Oxidation bezeichnet man in der Chemie die von Nathan Kornblum entdeckte Überführung von Alkylhalogeniden (Alkylbromide, Alkyliodide) in die jeweiligen Aldehyde bzw. Ketone durch einfaches Erhitzen in Dimethylsulfoxid (DMSO) unter Zugabe einer Base wie Triethylamin. Auch kann die Reaktion zur Überführung von α-halogenierten Carbonylverbindungen in die jeweiligen α-Oxoverbindungen dienen. DMSO wird hierbei sowohl als Lösungsmittel als auch als Oxidationsmittel verwendet, wobei es selbst zum übelriechenden Dimethylsulfid reduziert wird.[1][2][3]
Übersichtsreaktion
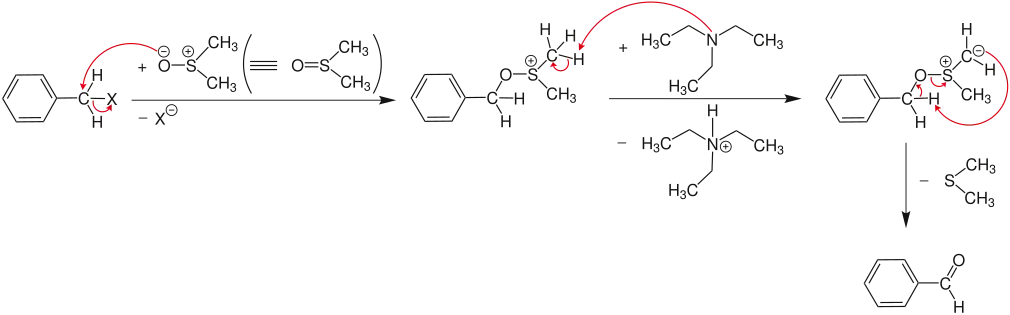
Die Oxidation von Alkyhalogeniden [Beispiel: Benzylhalogenid (X = Br oder I)] liefert Carbonylverbindungen (Beispiel: Benzaldehyd):

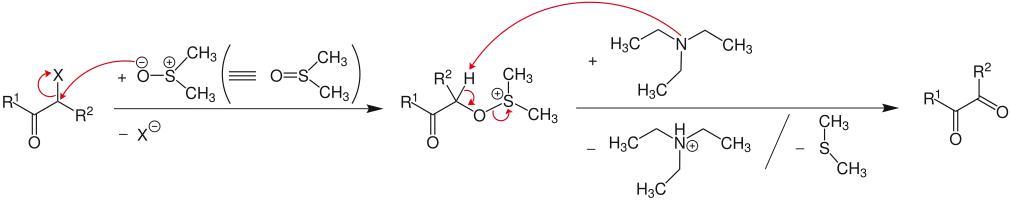
Bei der Oxidation von α-halogenierten (X = Br oder I) Carbonylverbindungen (R1, R2 = Wasserstoffatom oder Organylgruppe, wie beispielsweise Alkyl- oder Arylgruppe) entstehen α,β-Dicarbonylverbindungen:

Die Kornblum-Oxidation ist mit der Swern-Oxidation eng verwandt.
Mechanismus
Oxidation von Arylhalogeniden
Im ersten Schritt reagiert das Arylhalogenid in einer SN2-Reaktion mit dem nucleophilen Sauerstoff des Dimethylsulfoxid (DMSO). Dabei geht das Halogenid (X= Cl, Br, I) ab und es entsteht ein Alkoxysulfoniumsalz, welches im nächsten Schritt von einer Base (hier: Triethylamin) deprotoniert wird. Unter Abspaltung von Dimethylsulfid kommt es dann zur Bildung des jeweiligen Aldehyds bzw. Ketons.[4]
Oxidation von α-halogenierten Carbonylverbindungen
Im ersten Schritt greift der nucleophile Sauerstoff des Dimethylsulfoxid (DMSO) das α-Kohlenstoffatom an. Dieser Prozess verläuft über eine SN2-Reaktion, wobei das Halogenid (X= Cl, Br, I) abgespalten wird. Dabei entsteht ein Alkoxysulfoniumsalz, welches, im Gegensatz zur Oxidation von Alkyhalogeniden, nun nicht an der Methylgruppe, sondern am α-Kohlenstoffatom von einer Base (hier: Triethylamin) deprotoniert wird. Im letzten Schritt kommt es dann unter Abspaltung von Dimethylsulfid zur Bildung der jeweiligen α-Oxo Carbonylverbindung.[5]
Einzelnachweise
- Nathan Kornblum, Williard J. Jones, George J. Anderson: A New and Selective Method of Oxidation. The Conversion of Alkyl Halides and Alkyl Tosylates to Aldehydes. In: J. Am. Chem. Soc. Band 81, Nr. 15, 1959, S. 4113, doi:10.1021/ja01524a080.
- Nathan Kornblum, Jack W. Powers, George J. Anderson, Willard J. Jones, Harold O. Larson, Oscar Levand, William M. Weaver: A New and Selective Method of Oxidation. In: J. Am. Chem. Soc. Band 79, Nr. 24, 1957, S. 6562, doi:10.1021/ja01581a057.
- Paritosh Dave, Hoe-Sup Byun, Robert Engel: An Improved Direct Oxidation of Alkyl Halides to Aldehydes. In: Synth. Commun. Band 16, Nr. 11, 1986, S. 1343, doi:10.1080/00397918608056381.
- Siegfried Hauptmann: Organische Chemie. 2., durchgesehene Auflage. VEB Deutscher Verlag für Grundstoffindustrie, Leipzig 1985, ISBN 3-342-00280-8, S. 480.
- László Kürti, Barbara Czakó.: Strategic Applications of Named Reactions in Organic Synthesis: Background and Detailed Mechanisms. Elsevier Academic Press, 2005, ISBN 0-12-429785-4, S. 250–251.