Strontiumformiat
Strontiumformiat ist das Strontiumsalz der Ameisensäure mit der Konstitutionsformel Sr(HCOO)2.
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Strontiumformiat | |||||||||||||||
| Summenformel | C2H2SrO4 | |||||||||||||||
| Kurzbeschreibung |
weißer Feststoff[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | ||||||||||||||||
| Aggregatzustand |
fest[1] | |||||||||||||||
| Dichte | ||||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Löslichkeit | ||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Thermodynamische Eigenschaften | ||||||||||||||||
| ΔHf0 |
−1393,3 kJ/mol[6] | |||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Herstellung
Strontiumformiat kann durch Reaktion von Strontiumcarbonat[7] oder Strontiumhydroxid mit Ameisensäure dargestellt werden.[3]
Eigenschaften
Strontiumformiat kristallisiert als Dihydrat im orthorhombischen Kristallsystem in der Raumgruppe P212121 (Raumgruppen-Nr. 19) und den Gitterparametern a = 730 pm, b = 1199 pm und c = 713 pm. In der Elementarzelle befinden sich vier Formeleinheiten.[2]
Das Dihydrat gibt zwischen 50 und 150 °C sein Kristallwasser ab.[7] Das Anhydrat kristallisiert ebenfalls im orthorhombischen Kristallsystem in der gleichen Raumgruppe wie das Dihydrat.[8] Die Gitterparameter betragen a = 687 pm, b = 874 pm und c = 727 pm. In der Elementarzelle befinden sich ebenfalls vier Formeleinheiten.[2]
Strontiumformiat zersetzt sich beim Erhitzen unter Bildung von Strontiumoxid.[7]
Einzelnachweise
- William M. Haynes: CRC Handbook of Chemistry and Physics. CRC Press, 2016, ISBN 978-1-4987-5429-3 (books.google.com).
- Jean D'Ans, Ellen Lax: Taschenbuch für Chemiker und Physiker. 3. Elemente, anorganische Verbindungen und Materialien, Minerale, Band 3. 4. Auflage, Springer, 1997, ISBN 978-3-5406-0035-0, S. 744f. (eingeschränkte Vorschau in der Google-Buchsuche).
- R. Abegg, F. Auerbach: Handbuch der anorganischen Chemie, Verlag S. Hirzel, Bd. 2, 1908. S. 231; Volltext
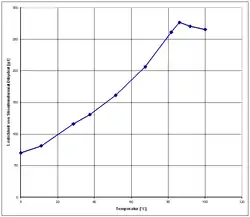
- H. Stanley: The Solubility of Some Salts of the Lower Fatty Acids. In: The Chemical News 1904, 89, S. 193. Volltext
- Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press/Taylor and Francis, Boca Raton, FL, Standard Thermodynamic Properties of Chemical Substances, S. 5-21.
- A. Gonzalez, J. Jimenez, F. Rull: "On the kinetics of thermal decomposition of anhydrous strontium formate in vacuum" in Crystal Research and Technology 1985, 20(1), S. K11-K14. doi:10.1002/crat.2170200130
- N. R. McQuaker, K. B. Harvey: Infrared and Raman Spectra of Single Crystals of Anhydrous Strontium Formate. In: Canadian Journal of Chemistry. 50 (10), 1972, S. 1453–1460, doi:10.1139/v72-231.