Snap-Tag
Ein SNAP-Tag ist ein Protein-Tag, das es ermöglicht, ein Protein in Zellen einer Zellkultur spezifisch mit einem Fluoreszenzfarbstoff mit hoher Quantenausbeute zu markieren.
Eigenschaften
Standardmäßig werden Untersuchungen heutzutage mit Protein-Tags, beispielsweise fluoreszierenden Proteinen durchgeführt, wie z. B. GFP (green fluorescent protein) oder YFP (yellow fluorescent protein). Die Methoden sind zwar verhältnismäßig leicht durchzuführen, weil die zugrundeliegenden Techniken mittlerweile sehr gut etabliert sind (Bildung von Fusionsproteinen und gezielte Expression in lebenden Zellen); auf der anderen Seite sind die photophysikalischen Eigenschaften der Proteine in der Regel nicht geeignet, um damit Einzelmolekülspektroskopie zu betreiben. Sie weisen im Vergleich zu kommerziell erhältlichen Farbstoffen eine sehr viel niedrigere Fluoreszenzquantenausbeute auf und werden durch Anregung mit einem fokussierten Laserstrahl im Zuge eines Photobleachings in der Regel schnell zerstört.
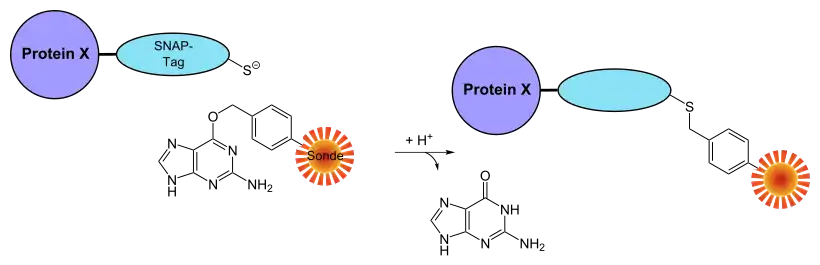
Das sogenannte SNAP-Protein ist ein Derivat eines in Säugetierzellen ubiquitären Enzyms, der O-6-Alkylguaninalkyltransferase (AGT), die üblicherweise im Organismus die Aufgabe hat, DNA-Defektstellen an Guanosinen zu reparieren. Hierbei wird eine Alkylgruppe von der O6-Alkylguanin-DNA auf eines der Cysteine der AGT übertragen. Das so kovalent modifizierte Enzym ist inaktiv. Die Substratspezifität der AGT ist niedrig, sie reagiert auch mit der Nucleobase O6-Benzylguanin (BG). Diese Eigenschaft, die auch das SNAP-Protein auszeichnet, macht man sich auch im Verlauf der Markierung des Fusionsproteins zunutze.
Zur Markierung muss, wie bei allen Protein-Tags, zuerst die DNA-Sequenz des Teilfragments der AGT leserasterkonform in die DNA-Sequenz des zu markierenden Proteins eingefügt werden. Daneben muss ein beliebiger Fluoreszenzfarbstoff chemisch an das SNAP-Substrat BG-NH2 gekoppelt werden. Über eine Aminogruppe am BG-NH2 wird der NHS-Ester des zu verwendenden Farbstoffs mittels einer SN2-Reaktion kovalent an das Substrat gebunden. Anschließend muss nun das Substrat mit dem Farbstoff durch die Membran hindurch in eine Zelle in Zellkultur diffundieren. Trifft es dort auf das SNAP-Protein, so wird durch den enzymatischen AGT-Anteil des Fusionsproteins die im Substrat enthaltene Etherfunktion gespalten, das Guanin wird dadurch freigesetzt und eine direkt kovalente Bindung zwischen dem zu untersuchenden Protein und dem Farbstoff wird ausgebildet.
SNAP-Tag ist, wie das hieraus entwickelte CLIP-Tag,[1] ein eingetragenes Warenzeichen des Biotechnologieunternehmens New England BioLabs (NEB). Das CLIP-Protein ist ebenfalls eine Variante der AGT, jedoch spezifisch für Benzylcytosin(BC)-Derivate. Damit lassen sich zwei Proteine parallel und unabhängig voneinander in einer Zelle markieren.[2]
Reaktionsschema
Quellen und weiterführende Literatur
- Keppler, A. et al. (2004): Labeling of fusion proteins of O6-alkylguanine-DNA alkyltransferase with small molecules in vivo and in vitro. In: Methods. Bd. 32, S. 437–444. PMID 15003606
- Keppler, A. et al. (2004): Labeling of fusion proteins with synthetic fluorophores in live cells. In: Proc. Natl. Acad. Sci. U.S.A. Bd. 101, S. 9955–9959. PMID 15226507
- Juillerat, A. et al. (2005): Engineering substrate specificity of O6-alkylguanine-DNA alkyltransferase for specific protein labeling in living cells. In: ChemBioChem Bd. 6, S. 1263–1269. PMID 15934048
- Brecht, A. & Gibbs, T. (2005): Self Labeling Protein Tags. (Memento vom 27. September 2007 im Internet Archive) In: Bioforum. Jg. 2005, Nr. 6, S. 50–51.
Weblinks
- Darstellung SNAP-Tag und CLIP-Tag (Memento vom 25. Juli 2011 im Internet Archive) (NEB)
Einzelnachweise
- A. Gautier, A. Juillerat, C. Heinis, I. R. Corrêa, M. Kindermann, F. Beaufils, K. Johnsson: An engineered protein tag for multiprotein labeling in living cells. In: Chem. Biol. Band 15, Nummer 2, Februar 2008, S. 128–136, doi:10.1016/j.chembiol.2008.01.007, PMID 18291317.
- K. Thorn: Genetically encoded fluorescent tags. In: Mol. Biol. Cell. Band 28, Nummer 7, April 2017, S. 848–857, doi:10.1091/mbc.E16-07-0504, PMID 28360214, PMC 5385933 (freier Volltext).