Piloty-Robinson-Pyrrolsynthese
Die Piloty-Robinson-Pyrrolsynthese, auch bekannt als Piloty-Robinson-Synthese, Piloty-Pyrrolsynthese oder Piloty-Robinson-Reaktion, ist eine Namensreaktion der organischen Chemie. Benannt wurde die Reaktion nach dem deutschen Chemiker Oskar Piloty, der sie im Jahre 1910 veröffentlichte,[1] dem englischen Chemiker und Nobelpreisträger Robert Robinson (1886–1975) und dessen Frau Gertrude Maud Robinson (1886–1954). Diese untersuchten die Reaktion vor allem im Hinblick auf den Reaktionsmechanismus.[2][3] Mit Hilfe der Reaktion lassen sich Pyrrole aus Azinen synthetisieren.[3]
Übersicht
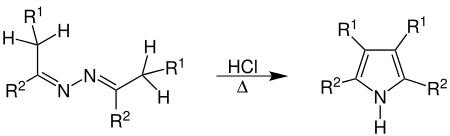
In Gegenwart einer katalytischen Menge einer Brønsted-Säure (z. B. HCl) reagieren Azine unter Wärmezufuhr und Ammoniakabspaltung zu Pyrrolderivaten.
Anstelle einer Brønsted-Säure kann auch eine Lewis-Säure verwendet werden. Im Falle von aliphatischen Azinen als Edukt können bei dieser Reaktion Pyrazoline als Nebenprodukt entstehen.
Mechanismus
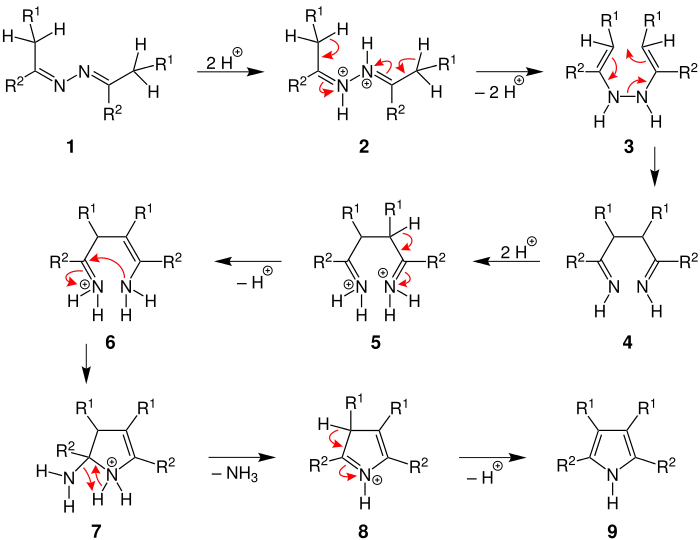 Mechanismus der Piloty-Robinson-Pyrrolsynthese; R1 = Wasserstoff, Alkylgruppe, Arylgruppe; R2 = Aklylgruppe, Arylgruppe
Mechanismus der Piloty-Robinson-Pyrrolsynthese; R1 = Wasserstoff, Alkylgruppe, Arylgruppe; R2 = Aklylgruppe, Arylgruppe
Zunächst werden beide Stickstoffatome des Azins 1 protoniert. Anschließend werden unter Abspaltung von zwei Protonen zwei C=C-Doppelbindungen ausgebildet 2. Eine Umlagerung von Elektronen 3 führt zur Neuausbildung einer C-C-Bindung unter gleichzeitiger Spaltung der N-N-Bindung. Es entsteht ein Diimin 4. Durch Protonierung der Iminfunktionen entsteht über die Zwischenstufe 5 das Iminiumion 6, das auch eine Enamingruppe enthält. Die Aminogruppe 6 greift nun intramolekular nucleophil das Kohlenstoffatom des Iminiumions an. In dem so gebildeten Fünfring 7 spaltet sich unter Ausbildung einer Doppelbindung Ammoniak (NH3) ab. Abschließend wird aus dem Kation 8 ein Proton abgespalten und es entsteht unter Aromatisierung das Pyrrolderivat 9.
Einzelnachweise
- O. Piloty: Synthese von Pyrrolderivaten: Pyrrole aus Succinylobernsteinsäureester, Pyrrole aus Azinen. In: Ber. dtsch. chem. Ges. 43, 1910, S. 489–498 (doi:10.1002/cber.19100430182).
- G. M. Robinson, R. Robinson: LIV.—A new synthesis of tetraphenylpyrrole. In: J. Chem. Soc., Trans. 113, 1918, S. 639–645 (doi:10.1039/CT9181300639).
- Z. Wang: Comprehensive Organic Name Reactions and Reagents, 3 Volume Set. John Wiley & Sons, Hoboken, New Jersey 2009, ISBN 978-0-471-70450-8, S. 2217–2218.