Perxenonsäure
Perxenonsäure ist eine Sauerstoffsäure des Xenons, welche nur in einer wässrigen Lösung existieren kann. Ihre Salze sind die Perxenate XeO64−.
| Strukturformel | |||||||
|---|---|---|---|---|---|---|---|
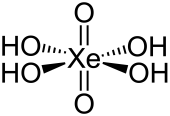 | |||||||
| Allgemeines | |||||||
| Name | Perxenonsäure | ||||||
| Summenformel | H4XeO6 | ||||||
| Externe Identifikatoren/Datenbanken | |||||||
| |||||||
| Eigenschaften | |||||||
| Molare Masse | 231,32 g·mol−1 | ||||||
| pKS-Wert | |||||||
| Sicherheitshinweise | |||||||
| |||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||
Gewinnung und Darstellung
Die Perxenonsäure wird durch Einleitung von Xenon(VIII)-oxid in Wasser hergestellt.
Das Perxenat-Ion XeO64− bildet sich bei der Disproportionierung der Xenonsäure H2XeO4.[4]
Eigenschaften
Analog zur Xenonsäure ist auch die Perxenonsäure und die Perxenate ein starkes Oxidationsmittel.[5] Der pH-Wert der Lösung soll zwischen −0,2 und 13 liegen. Die Bindungsenergie von H3XeO6− liegt bei 25 °C bei 0 ± 5 kJ·mol−1 und der von H2XeO62− bei 3 ± 2 kJ·mol−1.[1] Es besitzt die gleiche Struktur wie die Tellursäure und soll auch die Eigenschaften der Periodsäure teilen.[6]
Perxenonsäure ist nicht isolierbar, da es sich in sauren Bedingungen rasch in Xenon(VI)-oxid, Wasser und Sauerstoff zersetzt.[2]
Aufgrund dieser raschen Zersetzung ist auch die Protonierung von H3XeO6− in H4XeO6 nicht möglich.[2]
Salze der Perxenonsäure, die Perxenate, sind bereits bekannt wie etwa Bariumperxenat Ba2XeO6 oder Natriumperxenat Na4XeO6. Letzteres wurde sogar erfolgreich für die analytische Oxidation von Am3+ zu Am6+ verwendet.[7]
Literatur
- Walter C. Hamilton, James A. Ibers, Donald R. Mackenzie: Geometry of the Perxenate Ion. Science, 9. August 1963, S. 532–534, doi:10.1126/science.141.3580.532.
Einzelnachweise
- John H.Holloway, Eric G.Hope: Recent Advances in Noble-Gas Chemistry. In: Advances in Inorganic Chemistry. Band 46. Academic Press, 1998, ISBN 0-08-057895-0, S. 51–100, doi:10.1016/S0898-8838(08)60149-X.
- Ulrik K. Klaening, E. H. Appelman: Protolytic properties of perxenic acid. Oktober 1988, S. 3760–3762, doi:10.1021/ic00294a018.
- Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- David W. Oxtoby, Wade A. Freeman, Toby F. Block: Chemistry 4th Edition. ISBN 0-03-033188-9, Kap. 4, S. 87AP.
- Catherine E. Housecroft, A. G. Sharpe: Inorganic Chemistry. Pearson Education, 2005, ISBN 0-13-039913-2, S. 499.
- Bruno Jaselskis, Stanislaus Vas: Xenic Acid Reactions with vic-Diols. J. Am. Chem. Soc, 1964, S. 2078–2079, doi:10.1021/ja01064a041.
- H. P. Holcomb: Analytical Oxidation of Americium with Sodium Perxenate. Anal. Chem., März 1965, S. 415, doi:10.1021/ac60222a002.