Dewar-Benzol
Dewar-Benzol (auch Dewar-Benzen) ist der Trivialname für die Verbindung Bicyclo[2.2.0]hexa-2,5-dien, ein Valenzisomer des Benzols. Der Name beschreibt die von James Dewar vorgeschlagene Formel für C6H6, die seiner Meinung nach aber nicht Benzol darstellte. Dewar selbst hielt die von August Kekulé vorgeschlagene Formel für richtig.
| Strukturformel | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|
.svg.png.webp) | ||||||||||
| Allgemeines | ||||||||||
| Name | Dewar-Benzol | |||||||||
| Andere Namen |
| |||||||||
| Summenformel | C6H6 | |||||||||
| Kurzbeschreibung |
bei Raumtemperatur farblose, extrem explosive Flüssigkeit[1] | |||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||
| ||||||||||
| Eigenschaften | ||||||||||
| Molare Masse | 78,11 g·mol−1 | |||||||||
| Aggregatzustand |
flüssig[1] | |||||||||
| Sicherheitshinweise | ||||||||||
| ||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||
Geschichte und Eigenschaften
1962 konnte erstmals ein Derivat dieser Grundstruktur hergestellt werden, im Jahr darauf gelang die Synthese von reinem Dewar-Benzol. Es hat wegen der vieratomigen Ringe und der Doppelbindungen darin eine hohe Ringspannung und ist deshalb viel instabiler als Benzol. Außerdem ist es im Gegensatz zu Benzol nicht aromatisch und zeigt im NMR-Spektrum zwei anstatt eines Signals.
Dewar-Benzol ist bei Raumtemperatur eine farblose, extrem explosive Flüssigkeit, die aber routinemäßig als Feststoff bei 77 K oder als Niederdruckdampf (< 50 Torr) bei Raumtemperatur gehandhabt werden kann.[1]
Unter Normalbedingungen isomerisiert es mit einer Halbwertszeit von 37 Stunden[3] zu Benzol. Die Umwandlung ist kinetisch gehemmt: für die konzertierte Ringöffnung verlangen die Woodward-Hoffmann-Regeln (Erhaltung der Orbitalsymmetrie) konrotatorischen Verlauf (gleicher Drehsinn der CH-Bindungen an der sich öffnenden, zentralen CC-Bindung). Dabei ist es unerheblich, ob 4 oder 6 Elektronen in die Betrachtung einbezogen werden:
Eine konrotatorische Ringöffnung würde jedoch zu einer Benzol-Struktur mit einem endocyclischen Proton führen, was einer trans-Doppelbindung im Sechsring entspräche. Sie wird somit durch die sich aufbauende Ringspannung verhindert, woraus sich die vergleichsweise hohe Halbwertszeit des Dewar-Benzols erklärt.
Darstellung
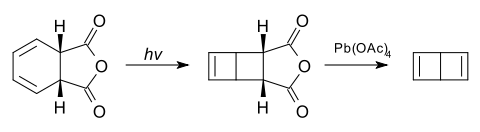
Es wird durch Bestrahlung von cis-1,2-Dihydrophthalsäureanhydrid und anschließender Oxidation mit Blei(IV)-acetat gewonnen.[4]
Einzelnachweise
- David W. T. Griffith, Jay E. Kent, M. F. O'Dwyer: The electronic spectrum of Dewar benzene. In: Journal of Molecular Spectroscopy. Band 58, Nr. 3, 1975, ISSN 0022-2852, S. 436–444, doi:10.1016/0022-2852(75)90223-4 (sciencedirect.com).
- Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- Eintrag zu Dewar-Benzol. In: Römpp Online. Georg Thieme Verlag, abgerufen am 25. Dezember 2014.
- E. E. van Tamelen, S. P. Pappas, K. L. Kirk: Valence bond isomers of aromatic systems. Bicyclo[2.2.0]hexa-2,5-dienes (Dewar benzenes). In: J. Am. Chem. Soc. Band 93, Nr. 23, 1971, S. 6092–6101, doi:10.1021/ja00752a021.