Palladium(IV)-oxid
Palladium(IV)-oxid, auch als Palladiumdioxid bezeichnet, ist eine chemische Verbindung der Elemente Palladium und Sauerstoff. Das Oxid ist als Hydrat dunkelrot, wasserfrei dagegen schwarz, es zerfällt bei 200 °C in Palladium(II)-oxid.
| Kristallstruktur | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
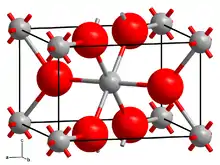 | |||||||||||||
| _ Pd4+ _ O2− | |||||||||||||
| Allgemeines | |||||||||||||
| Name | Palladium(IV)-oxid | ||||||||||||
| Andere Namen |
Palladiumdioxid | ||||||||||||
| Verhältnisformel | PdO2 | ||||||||||||
| Kurzbeschreibung |
dunkelroter oder schwarzer Feststoff[1] | ||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||
| |||||||||||||
| Eigenschaften | |||||||||||||
| Molare Masse | 138,42 g·mol−1 | ||||||||||||
| Aggregatzustand |
fest | ||||||||||||
| Schmelzpunkt | |||||||||||||
| Löslichkeit |
in Wasser, Säuren und Laugen unlöslich[2] | ||||||||||||
| Sicherheitshinweise | |||||||||||||
| |||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||
Gewinnung und Darstellung
Palladium(IV)-oxid fällt als Niederschlag beim Versetzen von PdCl62−-haltigen wässrigen Lösungen mit verdünnter Natronlauge an[2][4]:
Eine Lösung von Natriumcarbonat enthält ausreichend Hydroxidionen und kann anstatt von Natronlauge verwendet werden:
Eine weitere Synthesemethode ist die anodische Oxidation von Palladium(II)-nitrat.[4] Die Herstellung durch Oxidation von Palladium(II)-chlorid mit Ozon verläuft mit schlechten Ausbeuten, da das Palladiumdioxid mit der als Nebenprodukt anfallenden Salzsäure teilweise weiterreagiert.[4]
Eigenschaften
Physikalische Eigenschaften
Palladiumdioxid kristallisiert im tetragonalen Kristallsystem in der Raumgruppe P42/mnm (Raumgruppen-Nr. 136) mit den Gitterparametern a = 448 pm und c = 310 pm sowie zwei Formeleinheiten pro Elementarzelle (Rutilstruktur).[5]
Chemische Eigenschaften
Beim Erhitzen gibt Palladiumdioxid Sauerstoff ab und geht bei 200 °C in Palladium(II)-oxid über, das wiederum bei 875 °C in die Elemente zerfällt.[6]
Das Hydrat löst sich in konzentrierter Natriumhydroxidlösung unter Bildung von Hexahydroxopalladat-Ionen, die wasserfreie Substanz ist in Alkalien unlöslich.[6]
Ebenso ist das Hydrat des Palladiumdioxids in Salzsäure löslich, dabei werden Hexachlorpalladat(IV)-Ionen gebildet.[6]
Palladiumdioxid ist in Oxalsäure zunächst unter Gelbfärbung und Bildung von Dioxalatopalladat(II)-Ionen [Pd(OOC-COO)2]2− löslich[7][4], beim Kochen wird es zu elementarem Palladium reduziert.
Auch beim Kochen mit Essigsäure entsteht elementares Palladium.[4]
Einzelnachweise
- Palladium(IV)-oxid auf webelements.com
- A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 102. Auflage. Walter de Gruyter, Berlin 2007, ISBN 978-3-11-017770-1, S. 1732.
- Für diesen Stoff liegt noch keine harmonisierte Einstufung vor. Wiedergegeben ist eine von einer Selbsteinstufung durch Inverkehrbringer abgeleitete Kennzeichnung von Palladium dioxide im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 10. Juli 2020.
- Lothar Wöhler, James König: "Die Oxyde des Palladiums" in Zeitschr. f. Anorg. Chem. 1905, 46, S. 323ff. (Volltext).
- I. S. Shaplygin, G. L. Aparnikov, V. B. Lazarev: Preparation of palladium dioxide at high pressure. In: Zhurnal Neorganicheskoi Khimii. 1978, 23, 4, S. 884–887.
- A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 101. Auflage. Walter de Gruyter, Berlin 1995, ISBN 3-11-012641-9, S. 1520.
- M. M. Vezes: "Sur les sels complexes de palladium: palladoxalate" in Bull. Soc. Chim. 1899, (3)21, S. 172f. (Volltext).
