Optrode
Optrode, oder auch Optode, (opto-altgriechisch ὤψ (ops) für Auge) ist eine Bezeichnung für einen optischer Sensor, welcher unter Verwendung eines chemischen Energiewandlers zur Messung der Konzentration von Substanzen (wie beispielsweise des Sauerstoffgehalts in einer Wasserprobe) dient. Die Bezeichnungen wurden 1975 von Lübbers und Opitz präsentiert und sollen verdeutlichen, dass optische und nicht elektrische Signale gemessen werden.[1] Optroden werden aufgrund ihrer geringen Kosten, niedrigen Energieanforderungen und langer Stabilität immer beliebter.[2] Sie stellen brauchbare Alternativen zu Elektrodensensoren oder komplizierteren analytischen Instrumenten dar, vor allem im Gebiet der Umweltüberwachung.[3]
Aufbau
Eine Optrode ist aus drei Hauptkomponenten aufgebaut:
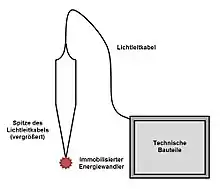
- Ein chemischer Energiewandler, der mit dem Analyten reagiert
- Ein Polymer um den chemischen Energiewandler zu immobilisieren
- Technische Bauteile (eine Lichtquelle, ein Detektor, Lichtleitkabel bzw. Glasfaserkabel und andere elektronische Komponenten)
Der Energiewandler wird spezifisch für die Messung des zu untersuchenden Analyten ausgewählt. Die Polymermatrix der Optroden ist hierbei meist an der Spitze der Lichtleitkabel angebracht. Bei Verwendung von Evaneszenzwellen ist sie hingegen auf einem Abschnitt des Leitkabels aufgetragen, der nicht umhüllt wurde.
Funktionsweise
Allgemeines Prinzip
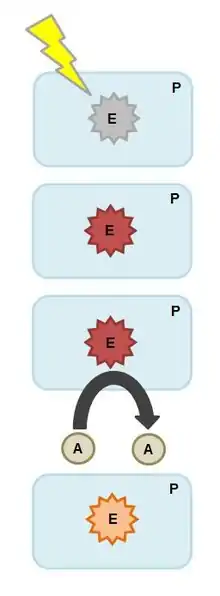
Optroden können verschiedene optische Messprinzipien anwenden, wie zum Beispiel Reflexion, Absorption, Evaneszenz, Lumineszenz (Fluoreszenz und Phosphoreszenz), Chemilumineszenz oder Oberflächenplasmonenresonanz. Das geläufigste Messprinzip ist hierbei allerdings die Verwendung von Lumineszenz, diese folgt in Lösung der linearen Stern-Volmer-Gleichung.[4]
Zunächst emittiert die Optrode Licht einer spezifischen Wellenlänge, hierdurch wird die Fluoreszenz des spezifisch ausgewählten Energiewandlers angeregt.[5] Diese Fluoreszenz wird durch den Analyten teilweise ausgelöscht, weshalb der Analyt auch als Quencher bezeichnet werden kann. Weil der fluoreszierende Energiewandler in einer Polymermatrix immobilisiert wird, entstehen Myriaden an Mikroumgebungen, welche in Bezug zum Analyten variierende Diffusionskoeffizienten aufweisen. Dies führt zu einem nicht-linearen Zusammenhang zwischen der messbaren Fluoreszenz und dem Quencher (Analyten). Mehr Quencher-Moleküle führen zu einem niedrigeren Emissionssignal, welches ein Maß für die Konzentration in der Probe darstellt.[6]
Sauerstoff-Optrode
Wird Sauerstoff als Quencher verwendet, z. B. in Verbindung mit Rutheniumkomplexen als Fluoreszierender Energiewandler,[7] spricht man von einer Sauerstoff-Optrode. Sie wurden 1939 von Kautsky entwickelt.[4] Die eigentliche Optrode ist bei niedriger Sauerstoffkonzentration am empfindlichsten da Sauerstoff die Lebensdauer der Fluoreszenz verringert, die Optrodensensoren können jedoch im gesamten Bereich von 0–100 % Sauerstoffsättigung in Wasser arbeiten. Die Kalibrierung erfolgt in gleicher Weise wie beim Clark-Sensor.[4] Da kein Sauerstoff verbraucht wird ist der Sensor unempfindlich gegenüber Rühren, das Signal wird sich hierdurch jedoch schneller stabilisieren.[2] Messungen können somit in einem stationären System durchgeführt werden. Der Druck während einer Messung kann diese in zwei Weisen beeinflussen, er destabilisiert den fluoreszierenden Energiewandler und verringert zudem das Quenching.[4] Großer Kritikpunkt ist allerdings die geringere Auflösung, verglichen mit modernen kathodischen Mikrosensoren.[8] Sauerstoff-Optroden finden häufig Anwendung in Sauerstoffmessungen von Gewässern. Gemessen wird hierbei der „freie“ gelöste Sauerstoff und nicht die in den Wassermolekülen enthaltenen Sauerstoffatome. Diese Messungen sind seit 2006 in der Umweltüberwachung von immenser Bedeutung,[4] vor allem in Sauerstoffarmen Regionen wie u. a. flachen Küstengebieten mit signifikanten Algenblüten, Fjorden oder andere Gebieten mit begrenztem Austausch von Wasser, um Fischfarmen oder in Gebieten von Interesse für das Abladen von Müll.[2]
Glucose-Optrode
Glucose-Optroden sind biochemische Sensoren zur Bestimmung der Konzentration von Glucose in einer Lösung unter Verwendung optischer Messprinzipien. Meist wird hierbei Glucose-Oxidase (GOD) in einer Matrix oder Membran immobilisiert, ein Enzym das die Oxidation von Glucose katalysiert.[9][10] Es wird auch in nicht-optischen Messmethoden verwendet, wie zum Beispiel im GOD-Test.
Somit kann die Abnahme von Sauerstoff in Korrelation gesetzt werden zu der Glucosekonzentration. Gemessen wird folglich nicht direkt Glucose, sondern Sauerstoff, weshalb sie genauer betrachtet auch als modifizierte Sauerstoff-Optrode beschrieben werden kann. Alternative Messmethoden verwenden pH sensitive Farbstoffe um die Änderung der Lichtabsorption des Farbstoffes während der GOD-Oxidation zu messen. Jedoch sind diese Abhängig von der Pufferkapazität des Mediums, weshalb die Verwendung von Sauerstoff-Optroden, trotz ihrer Limitierungen hinsichtlich Auflösung, bevorzugt wird.[10]
Ein weiteres Messprinzip wurde 1982 von Schulz et al. beschrieben; die Verwendung eines Immunaffinität-Glucose-Sensors, basierend auf der reversiblen kompetitiven Bindung von Glucose und Fluorescein-markiertem Dextran an die Zuckerbindungsstelle des Proteins Concanavalin A. In einer Hohlfaser wird durch Membranen ein abgetrenntes Messvolumen geschaffen. In diesem Messvolumen befinden sich, an das an der Innenfläche der Hohlfaser immobilisierte Protein Concanavalin A gebundene, Fluorescein-markierte Dextranmoleküle, welche zur Fluoreszenz angeregt werden können. Glucose kann durch die Membran in das Messvolumen eindringen und konkurriert nun mit dem Dextran um die Plätze am Protein und es stellt sich ein Gleichgewicht ein. Die Optrode misst nun die Fluoreszenzänderung und setzt diese in Korrelation zu der Glucosekonzentration. Das Prinzip kann somit in der Praxis unter Verwendung einer Dialysehohlfaser zur Bestimmung der Glucosekonzentration im Blut verwendet werden, da das Dextran die Membran nicht durchdringen kann und in den Blutkreislauf gelangt. Jedoch haben Messungen mit dieser Methode nur eine sehr langsame Reaktionszeit.[11]
Einzelnachweise
- W. Göpel, T. A. Jones, M. Kleitz, J. Lundström, T. Seiyama (Hrsg.): Chemical and Biochemical Sensors: Part I (= W. Göpel, J. Hesse, J.N. Zemel [Hrsg.]: Sensors – A Comprehensive Survey. Vol. 2). VCH Verlagsgesellschaft mbh., Weinheim / New York / Basel / Cambridge / Tokyo 1991, ISBN 3-527-26768-9, S. 576.
- Oxygen Optode 4330/4330F. (PDF) In: Aanderaa. Abgerufen am 20. April 2018 (englisch).
- A. Tengberg et al.: Evaluation of a lifetime-based Optode to measure Oxygen in aquatic Systems. In: Limnology and Oceanography: Methods. Band 4, 2006, S. 7–17, doi:10.4319/lom.2006.4.7.
- H. C. Bittig et al.: Oxygen Optode Sensors: Principle, Characterisation, Calibration, and Application in the Ocean. In: Frontiers in Marine Science. Band 4, 2018, S. 429 ff., doi:10.3389/fmars.2017.00429.
- Oxygen Optode. In: Ocean Networks Canada. Abgerufen am 20. April 2018 (englisch).
- Microoptode. In: Unisense. Abgerufen am 20. April 2018 (englisch).
- P. Hartmann et al.: Photobleaching of a ruthenium complex in polymers used for oxygen optodes and its inhibition by singlet oxygen quenchers. In: Sensors and Actuators B: Chemical. Band 51, 1998, S. 196–202, doi:10.1016/S0925-4005(98)00188-9.
- N. P. Revsbech et al.: Construction of STOX Oxygen Sensors and their Application for Determination of O2 Concentrations in Oxygen Minimum Zones. In: Methods Enzymol. Band 486, 2011, S. 325–341, doi:10.1016/B978-0-12-381294-0.00014-6.
- G. Harsanyi: Polymer Films in Sensor Applications. Technomic Publishing AG, Lancaster / Basel 1995, ISBN 1-56676-201-4.
- M. C. Moreno-Bondi et al.: Oxygen Optrode for Use in a Fiber-Optic Glucose Biosensor. In: Anal. Chem. Band 62, 1990, S. 2377–2380, doi:10.1021/ac00220a021.
- J. S. Schultz: Affinity sensor: a new technique for developing implantable sensors for glucose and other metabolites. In: Diabetes Care. Band 5, 1982, S. 245–253, doi:10.2337/diacare.5.3.245.