Naxos-Krankheit
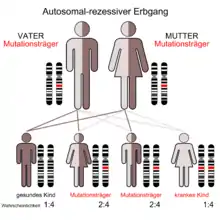
Die Naxos-Krankheit, auch als Naxos-Syndrom bezeichnet, ist eine seltene autosomal-rezessiv vererbte Krankheit.
| Klassifikation nach ICD-10 | |
|---|---|
| Q87.8 | Sonstige näher bezeichnete angeborene Fehlbildungssyndrome, anderenorts nicht klassifiziert |
| ICD-10 online (WHO-Version 2019) | |
Klinisches Bild

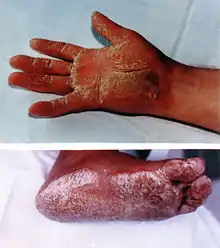
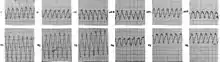
Die Naxos-Krankheit ist äußerlich vor allem durch den kutanen Phänotyp mit wolligem Haar und Keratoderma, einer speziellen Form eines Keratoms (Keratoma hereditarium palmoplantare), an den Handflächen (palmar) und Fußsohlen (plantar) – palmoplantares[2] Keratoderma – gekennzeichnet. Kardiologisch manifestiert sich die Naxos-Krankheit durch eine arrhythmogene rechtsventrikuläre Kardiomyopathie (ARVCM).
Während die palmoplantare Keratoderma erst im ersten Lebensjahr auftritt, ist das wollige Haar in den meisten Fällen bereits bei der Geburt vorhanden.[3] In der Adoleszenz zeigen alle Patienten Symptome einer Kardiomyopathie.[4] Die Betroffenen haben Synkopen (Kreislaufkollapse) und anhaltende ventrikuläre Tachykardien („Herzrasen“). Der plötzliche Herztod ist eine häufige Folge der Erkrankung des Herzmuskels (Myokard). Die Symptome einer Rechtsherzinsuffizienz sind im Endstadium der Naxos-Krankheit zu beobachten.[1]
Häufigkeit
Die Krankheit wurde erstmals bei Patienten von der griechischen Insel Naxos beschrieben, was der Krankheit ihren Namen gab, inzwischen sind aber auch Fälle auf anderen Inseln der Ägäis sowie in der Türkei,[5] in Israel[6] und in Saudi-Arabien[7] bekannt. Die weltweite Krankheitshäufigkeit ist unbekannt. Auf Naxos wird sie auf 1:1000 geschätzt.[1]
Etwa 5 % der Bevölkerung auf Naxos sind heterozygote Träger der Mutation. Abgesehen von einer kleinen Minderheit mit wolligem Haar zeigt die Mehrzahl dieser heterozygoten (mischerbigen) Menschen ein normales Erscheinungsbild.[1][4] Nur wenn zwei (gesunde) Merkmalsträger ein Kind zeugen, besteht nach den Mendelschen Regeln eine statistische Wahrscheinlichkeit von 25 %, dass das Kind die Naxos-Krankheit bekommt. Zu 50 % besteht die Chance, dass es gesunder Erbträger ist und zu 25 %, dass es gesund und kein Erbträger ist.
Genetik und Pathologie
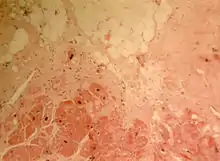
Die Ursache für die Naxos-Krankheit ist eine Mutation im JUP-Gen, das sich beim Menschen auf Chromosom 17 Genlocus q21 befindet und für das Protein Plakoglobin codiert.[8] Plakoglobin ist ein wichtiges zytoplasmatisches Protein. Es besteht aus 744 Aminosäuren, hat eine molare Masse von 81,75 kDa und ist ein Bestandteil des Desmosoms. Als Zelladhäsionsmolekül bindet es normalerweise an das integrale Membranprotein Desmoglein I. Diese Bindung ist für den Zellkontakt wichtig.[9] Mutationen im JUP-Gen können diesen Zellkontakt nachhaltig verändern und so die Symptome der Naxos-Krankheit auslösen.
Eine Deletion von zwei Nukleinbasen in der Position 2157–2158 im JUP-Gen konnte bei 19 Patienten mit Naxos-Krankheit festgestellt werden. Diese Deletion bewirkt einen Frameshift, der wiederum zur Folge hat, dass fünf Aminosäuren des dreizehnten Armadillo-Repeats verändert werden und die c-terminale Domäne mit 56 Aminosäuren abgeschnitten wird.[9] Das Genprodukt faltet falsch und wird durch die Proteinqualitätskontrolle proteasomal abgebaut. Dies hat unmittelbare Auswirkungen auf die Integrität der Zellverbände. Bei der Naxos-Krankheit zeigt sich dies vor allem an der Haut und im Myokard (Herzmuskel). Werden die wegen der Mutation deutlich geschwächten zellulären Kontakte unterbrochen, so tritt der Zelltod ein und die abgestorbenen Zellen werden durch Fett und fibröses Gewebe ersetzt.[8][9]
Diagnose
Die Diagnose kann anhand des auffälligen klinischen Bildes gestellt werden. Eine sichere Diagnosestellung bietet die DNA-Analyse.
Das ebenfalls autosomal-rezessiv vererbte Carvajal-Syndrom ist der Naxos-Krankheit von der Symptomatik her sehr ähnlich. Auch hier ist der Phänotyp durch Wollhaare und Keratosis palmoplantaris gekennzeichnet. Die genetische Basis des Carvajal-Syndroms sind jedoch Mutationen im DSP-Gen, das sich auf Chromosom 6 Genlocus p24 befindet und für das Zelladhäsionsprotein Desmoplakin codiert. Allerdings führt dieser Gendefekt zu einer dilatativen Kardiomyopathie, bevorzugt im linken Ventrikel, und die Kardiomyopathie tritt früher ein (early-onset).[1][3][10]
Therapie und Prävention
Das primäre Ziel der Behandlung von Patienten mit der Naxos-Krankheit ist die Verhinderung des plötzlichen Herztods. Die Implantation eines Kardioverter-Defibrillators ist bei symptomatischen Patienten meist schon vor dem Erreichen des 35. Lebensjahrs angezeigt.[4][11][12]
Medikamentös werden üblicherweise Antiarrhythmika, wie beispielsweise Sotalol oder Amiodaron, oft in Kombination mit klassischen Betablockern, verabreicht.[13][14] Patienten mit kongestiver Herzinsuffizienz erhalten meist Diuretika und ACE-Hemmer. Im Endstadium ist eine Herztransplantation die Ultima Ratio.[1]
Darüber hinaus gibt es Ansätze zur Prävention der Naxos-Krankheit. Durch ein systematisches Screening der Risikogruppen sollen die heterozygoten Merkmalsträger identifiziert werden.[1]
Erstbeschreibung
Die Naxos-Krankheit wurde erstmals 1986 von einer Arbeitsgruppe um den griechischen Kardiologen Nikos Protonotarios[15] bei einer Population auf der Insel Naxos beschrieben.[16] Ihre Patienten mit Wollhaar und palmoplantarer Keratose zeigten kardiale Rhythmusanomalien und in den Familien traten auffällig viele Fälle von plötzlichem Herztod auf. Anhand des Stammbaums der Patienten konnten sie den autosomal-rezessiven Erbgang identifizieren.[15] Sie untersuchten vier Familien mit insgesamt neun Fällen von Naxos-Krankheit.[17] Der Begriff «Naxos-Krankheit» (Naxos disease) wurde 1994 durch Guy Fontaine, Nikos Protonotarios, Adalena Tsatsopoulou und Kollegen[18] geprägt.[19] Seit 1995 ist die Naxos-Krankheit von der Weltgesundheitsorganisation als rezessive Form der arrhythmogenen rechtsventrikulären Kardiomyopathie klassifiziert.[20]
Einzelnachweise
- N. Protonotarios, A. Tsatsopoulou: Naxos disease: cardiocutaneous syndrome due to cell adhesion defect. In: Orphanet Journal of Rare Diseases. Band 1, 2006, S. 4. doi:10.1186/1750-1172-1-4. PMID 16722579. PMC 1435994 (freier Volltext). (Review).
- Palmoplantar bedeutet Die Handflächen und Fußsohlen betreffend.
- A. S. Coonar, N. Protonotarios u. a.: Gene for arrhythmogenic right ventricular cardiomyopathy with diffuse nonepidermolytic palmoplantar keratoderma and woolly hair (Naxos disease) maps to 17q21. In: Circulation. Band 97, Nummer 20, Mai 1998, S. 2049–2058. PMID 9610536.
- N. Protonotarios, A. Tsatsopoulou u. a.: Genotype-phenotype assessment in autosomal recessive arrhythmogenic right ventricular cardiomyopathy (Naxos disease) caused by a deletion in plakoglobin. In: Journal of the American College of Cardiology. Band 38, Nummer 5, November 2001, S. 1477–1484. PMID 11691526.
- N. Narin, M. Akcakus u. a.: Arrhythmogenic right ventricular cardiomyopathy (Naxos disease): report of a Turkish boy. In: Pacing and clinical electrophysiology. Band 26, Nummer 12, Dezember 2003, S. 2326–2329. PMID 14675023. (Review).
- K. Djabali, A. Martinez-Mir u. a.: Evidence for extensive locus heterogeneity in Naxos disease. In: Journal of Investigative Dermatology. Band 118, Nummer 3, März 2002, S. 557–560. doi:10.1046/j.0022-202x.2001.01627.x. PMID 11874502.
- I. Bukhari, N. Juma'a: Naxos disease in Saudi Arabia. In: Journal of the European Academy of Dermatology and Venereology : JEADV. Band 18, Nummer 5, September 2004, S. 614–616. doi:10.1111/j.1468-3083.2004.01010.x. PMID 15324409.
- G. McKoy, N. Protonotarios u. a.: Identification of a deletion in plakoglobin in arrhythmogenic right ventricular cardiomyopathy with palmoplantar keratoderma and woolly hair (Naxos disease). In: The Lancet. Band 355, Nummer 9221, Juni 2000, S. 2119–2124. doi:10.1016/S0140-6736(00)02379-5. PMID 10902626.
- Junction Plakoglobin. In: Online Mendelian Inheritance in Man. (englisch)
- N. Protonotarios, A. Tsatsopoulou, G. Fontaine: Naxos disease: keratoderma, scalp modifications, and cardiomyopathy. In: Journal of the American Academy of Dermatology. Band 44, Nummer 2, Februar 2001, S. 309–311. PMID 11174397.
- K. Gatzoulis, N. Protonotarios u. a.: Implantable defibrillator therapy in Naxos disease. In: Pacing and clinical electrophysiology : PACE. Band 23, Nummer 7, Juli 2000, S. 1176–1178. PMID 10914377.
- D. Corrado, L. Leoni u. a.: Implantable cardioverter-defibrillator therapy for prevention of sudden death in patients with arrhythmogenic right ventricular cardiomyopathy/dysplasia. In: Circulation. Band 108, Nummer 25, Dezember 2003, S. 3084–3091. doi:10.1161/01.CIR.0000103130.33451.D2. PMID 14638546.
- T. Wichter, M. Borggrefe u. a.: Efficacy of antiarrhythmic drugs in patients with arrhythmogenic right ventricular disease. Results in patients with inducible and noninducible ventricular tachycardia. In: Circulation. Band 86, Nummer 1, Juli 1992, S. 29–37. PMID 1617780.
- G. Fontaine, F. Fontaliran u. a.: Arrhythmogenic right ventricular dysplasia. In: Annual review of medicine. Band 50, 1999, S. 17–35. doi:10.1146/annurev.med.50.1.17. PMID 10073261. (Review).
- N. Protonotarios, A. Tsatsopoulou u. a.: Cardiac abnormalities in familial palmoplantar keratosis. In: British Heart Journal. Band 56, Nummer 4, Oktober 1986, S. 321–326. PMID 2945574. PMC 1236865 (freier Volltext).
- B. Lüderitz: Naxos disease. In: Journal of interventional cardiac electrophysiology : an international journal of arrhythmias and pacing. Band 9, Nummer 3, Dezember 2003, S. 405–406. PMID 14618065.
- Naxos-Krankheit. In: Online Mendelian Inheritance in Man. (englisch)
- G Fontaine, N. Protonotarios, A. Tsatsopoulou u. a.: Comparisons between Naxos disease and arrhythmogenic right ventricular dysplasia by electrocardiography and biopsy. In: Circulation. Band 90, Nummer 2, 1994, S. 3233.
- B. Lüderitz: Profiles in cardiac pacing and electrophysiology. John Wiley & Sons, 2005, ISBN 1-4051-3116-0, S. 204–205. eingeschränkte Vorschau in der Google-Buchsuche.
- P. Richardson, W. McKenna u. a.: Report of the 1995 World Health Organization/International Society and Federation of Cardiology Task Force on the Definition and Classification of cardiomyopathies. In: Circulation. Band 93, Nummer 5, März 1996, S. 841–842. PMID 8598070.
Weiterführende Literatur
- G. Meera, D. Prabhavathy u. a.: Naxos disease in two siblings. In: International journal of trichology. Band 2, Nummer 1, Januar 2010, S. 53–55. doi:10.4103/0974-7753.66917. PMID 21188028. PMC 3002416 (freier Volltext).
- The discovery of Naxos disease. In: European Heart Journal. Band 30, Nummer 21, November 2009, S. 2546–2548. PMID 19891084.
- N. Protonotarios, A. Tsatsopoulou: Naxos Disease. (PDF; 198 kB) In: Indian Pacing and Electrophysiology. Band 5, Nummer 2, S. 76–80.
Weblinks
- Naxos Disease. In: Online Mendelian Inheritance in Man. (englisch)
- Naxos-Krankheit. In: Orphanet (Datenbank für seltene Krankheiten).