Natriumphosphinat
Natriumphosphinat ist eine anorganische chemische Verbindung des Natriums aus der Gruppe der Phosphinate.
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
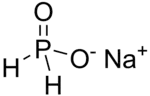 | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Natriumphosphinat | ||||||||||||||||||
| Andere Namen | |||||||||||||||||||
| Summenformel | NaH2PO2 | ||||||||||||||||||
| Kurzbeschreibung |
weißer Feststoff[2] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 87,96 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest[2] | ||||||||||||||||||
| Dichte |
1,77 g·cm−3[2] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Löslichkeit | |||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Toxikologische Daten | |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
Gewinnung und Darstellung
Natriumphosphinat kann durch Reaktion von weißem Phosphor mit Natronlauge gewonnen werden.[4]
Es kann durch neutralisieren von Hypophosphorsäure oder einer Calciumphosphinatlösung mit Natriumcarbonat hergestellt werden.[6]
Bei der Reaktion in wässrigen Lösungen entsteht das Monohydrat.[7]
Eigenschaften
Natriumphosphinat ist ein kristalliner weißer Feststoff, der leicht löslich in Wasser ist. Er zersetzt sich bei Erhitzung über 260 °C.[2] In wässriger Lösung zersetzt es sich beim Erhitzen unter Abgabe von selbstentzündlichem Phosphorwasserstoff und Bildung von Dinatriumhydrogenphosphat.[7]
Das Hydrat NaH2PO2·H2O hat eine Kristallstruktur mit der Raumgruppe P21/n (Raumgruppen-Nr. 14, Stellung 2).[8]
Verwendung
Natriumphosphinat wird als Thieles Reagenz zum Selen-Nachweis und früher auch in Tonika verwendet. Im Labor dient es als Reduktionsmittel, zum Beispiel zur Herstellung von Nanopartikeln, besonders aber für die stromlose Abscheidung von Phosphor-haltigen Nickelschichten auf Metallen oder Kunststoffen und anderen nichtleitenden Materialien. Natriumphosphinat eignet sich auch zur Abscheidung von Palladium auf Glas.[4]
Einzelnachweise
- Eintrag zu SODIUM PHOSPHINATE in der CosIng-Datenbank der EU-Kommission, abgerufen am 20. November 2021.
- Eintrag zu Natriumphosphinat in der GESTIS-Stoffdatenbank des IFA, abgerufen am 9. März 2016. (JavaScript erforderlich)
- William M. Haynes: CRC Handbook of Chemistry and Physics, 96th Edition. CRC Press, 2015, ISBN 978-1-4822-6097-7, S. 91 (eingeschränkte Vorschau in der Google-Buchsuche).
- Eintrag zu Natriumphosphinat. In: Römpp Online. Georg Thieme Verlag, abgerufen am 9. März 2016.
- Datenblatt Sodium hypophosphite monohydrate, ≥99% bei Sigma-Aldrich, abgerufen am 9. März 2016 (PDF).
- Eintrag zu Sodium hypophosphite in der Hazardous Substances Data Bank, abgerufen am 9. März 2016 (online auf PubChem).
- Hermann Hager: Hagers Handbuch der Pharmazeutischen Praxis für Apotheker, Arzneimittelhersteller, Drogisten, Ärzte und Medizinalbeamte Zweiter Band. Springer-Verlag, 1949, ISBN 978-3-642-49767-4, S. 302 (eingeschränkte Vorschau in der Google-Buchsuche).
- M. Catti: Pseudo-symmetry and hydrogen bonding in the crystal structure of NaH2PO2·4/5H2O. In: Acta Crystallographica Section B Structural Crystallography and Crystal Chemistry. 35, S. 1041, doi:10.1107/S0567740879005537.