Natriumoxalat
Natriumoxalat ist ein Natriumsalz der Oxalsäure mit der Summenformel Na2C2O4. Es gehört zur Gruppe der Oxalate.
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
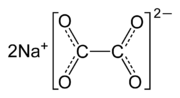 | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Natriumoxalat | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel | Na2C2O4 | |||||||||||||||
| Kurzbeschreibung |
farblose und geruchlose Kristalle[2] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 134,01 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||
| Dichte |
2,27 g·cm−3[2] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Löslichkeit |
| |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Herstellung und Vorkommen
Natriumoxalat kann durch die Umsetzung von Oxalsäure mit Natronlauge gewonnen werden.
Großtechnisch wird es aus Natriumformiat bei einer Temperatur von 360 °C hergestellt.
Außerdem fällt es in großen Mengen als Abfallstoff beim Bayer-Verfahren (Herstellung von Aluminiumhydroxid "Tonerdehydrat") an.[3]
In der Natur kommt Natriumoxalat als das sehr seltene Mineral Natroxalat vor.
Eigenschaften
Natriumoxalat ist ein farbloses als Pulver gut rieselfähiges Salz, das nicht hygroskopisch wirkt und sich nur mäßig in Wasser löst. Es kristallisiert im monoklinen Kristallsystem in der Raumgruppe P21/a (Raumgruppen-Nr. 14, Stellung 3).[4]
Bei 290 °C beginnt die Zersetzung von Natriumoxalat in Natriumcarbonat und Kohlenmonoxid.[5]
Die Lösungsenthalpie von Natriumoxalat bei 298,15 K beträgt 13,86 kJ·mol−1.[6]
Verwendung
Es kann in Verbindung mit Mangan(II)-sulfid zur Einstellung von Kaliumpermanganat-Maßlösungen (Urtitersubstanz nach Sörensen) eingesetzt werden (siehe auch Manganometrie). Bei der Galvanisierung findet eine Lösung namens Natrium-Eisen(III)-oxalat Anwendung, die unter anderem aus Natriumoxalat gewonnen wird. Des Weiteren kann es als Farbgeber (gelb/orange) in der Pyrotechnik verwendet werden. In der Metallurgie findet es Verwendung z. B. bei der Röstung von Vanadiumerzen im Drehofen (Umsetzung von Vanadium(V)-oxid zu Natriummetavanadat). Weitere Anwendungen findet es als Hilfsmittel in der Textilindustrie und als Inhaltsstoff bei Spezialzementen.
Einzelnachweise
- Eintrag zu SODIUM OXALATE in der CosIng-Datenbank der EU-Kommission, abgerufen am 1. November 2021.
- Eintrag zu Natriumoxalat in der GESTIS-Stoffdatenbank des IFA, abgerufen am 8. Januar 2018. (JavaScript erforderlich)
- Eintrag zu Natriumoxalat. In: Römpp Online. Georg Thieme Verlag, abgerufen am 29. September 2014.
- J. Lowe, M. Ogden, A. McKinnon, G. Parkinson: Crystal growth of sodium oxalate from aqueous solution. In: Journal of Crystal Growth 2002, 237-239, S. 408–413. doi:10.1016/S0022-0248(01)01864-4.
- T. Yoshimori, Y. Asano, Y. Toriumi and T. Shiota: Investigation on the drying and decomposition of sodium oxalat. In: Talanta 1978, 25(10), S. 603–605. doi:10.1016/0039-9140(78)80158-1.
- M. Z. H. Rozaini, P. Brimblecombe: The solubility measurements of sodium dicarboxylate salts; sodium oxalate, malonate, succinate, glutarate, and adipate in water from T = (279.15 to 358.15) K. In: The Journal of Chemical Thermodynamics 2009, 41(9), S. 980–983. doi:10.1016/j.jct.2009.03.017.
