Morgenammer
Die Morgenammer (Zonotrichia capensis) ist eine Art aus der Familie der Neuweltammern. Im Deutschen wird sie auch Rostscheitelammer oder Braunnacken-Ammer genannt. Sie kommt in 29 Unterarten in großen Teilen Südamerikas vor.
| Morgenammer | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|

Morgenammer (Zonotrichia capensis) | ||||||||||||
| Systematik | ||||||||||||
| ||||||||||||
| Wissenschaftlicher Name | ||||||||||||
| Zonotrichia capensis | ||||||||||||
| (Statius Müller, 1776) |
Beschreibung
Die Tiere sind zwischen 15 und 18 cm lang und etwa 18 g schwer. Adulte Morgenammern haben einen schwarzen Scheitel mit einem schmalen grauen Mittelstreifen; die Federn bilden am Oberkopf häufig eine kleine Haube. Diese Haubenfedern sind etwa 9 mm lang und bei Weibchen und Männchen gleich. Die Iris ist rot-braun, die Beine sind fleischfarben. Sie sind, wie auch der Schnabel, im Verhältnis zum restlichen Körper relativ groß. Die durchschnittliche Schnabellänge beträgt etwa 13,2 mm. In Allgemeinen sind die Morgenammern arider Gegenden heller als die, die in einer humiden Gegend leben.

Der Augenstreif ist schwarz. Der Ohrfleck ist schwarz mit einem großen grauen Fleck in der Mitte. Ein fuchsrotes Halsband haben alle Unterarten der Morgenammer. Die Oberseite ist warm oliv-braun mit kräftigen schwarzen Streifen an Rücken und Schultern. Zur Unterseite hin wird die Farbe brauner und geht in Grau über. Der Schwanz ist ebenfalls schwarz-braun, bei südlichen Population ist er ein wenig grau getönt. Kehle und vordere Halsseiten sind weiß, die Brust zeigt ein schmales schwarzes, in der Mitte unterbrochenes Band. Auf beiden Seiten der Brust liegen große, fuchsrote Flecken. Die Unterseite ist verwaschen weißlich.
Die Flügel sind schwarz-braun. Die Form und Größe der Flügel variiert zwischen rundlichen, kurzen Flügeln und langen, spitzen Flügeln. Im Allgemeinen sind die Flügel der südlichen Populationen größer als die der nördlicher beheimateten Individuen. Am Bogen oder Rand der Flügeln sind fast immer gelbe Streifen zu finden.
Jugendkleid
Bei Vögeln im Jugendkleid, dem zweiten Federkleid nach dem Schlüpfen, ist die Oberseite braun, weniger oliv und weniger rötlich als bei adulten Tieren. Beim Ohrfleck ist das graue Zentrum noch nicht ausgebildet. Die Haube ist braun gestreift mit einer schwarzen Mittellinie und ist kürzer als bei den Adulten, die Nacken-Halskrause fehlt. An der Unterseite finden sich an Hals, Brust und Flanken schwarze Streifen. Die Flügel sind bräunlicher, die Spitzen der Flügel sind weniger weiß und die Federn sind noch weniger fest als bei Adulten. Die Größe der Flügel und des Schwanzes gleicht schon den Adulten. Dieses Jugendkleid tragen die Jungvögel für einige Wochen. Danach folgt die postjuvenale Mauser, bei der alle Körperfedern, nicht aber die Flügeldecken und die Schwanzfedern ersetzt werden. Im ersten Winterkleid sind die Jungvögel den Adulten schon sehr ähnlich.
Gesang
Das Männchen hat einen, sehr variablen Gesang. In der Regel besteht der Gesang aus einer Serie von klaren Pfiffen, denen ein Triller oder abgehackte, stotternde Laute folgen.
Bei der Untersuchung der Gesangstruktur verschiedener Populationen der Morgenammer in Brasilien wurde festgestellt, dass es sich um sehr einfache Modulationen von nur wenigen Tönen handelt. Der Gesang der in Brasilien lebenden Morgenammern ist dem der in Argentinien beheimateten sehr ähnlich. Zwischen den Populationen existieren jedoch regionale Dialekte. Es gibt Individuen, die zwei Gesangtypen beherrschen.[1][2]
Verbreitungsgebiet und Lebensraum
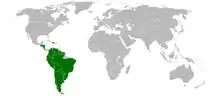
Die Morgenammer ist die einzige in Südamerika verbreitete Art der Gattung Zonotrichia. Sie kommt in ganz Südamerika, mit Ausnahme des Orinoco- und Amazonas-Deltas vor und findet sich in den Anden in Höhenlagen von 1.000 bis 3.700 m, in Chile ist sie in wüstenartigen Gebieten sowie im gemäßigten Regenwald von 0 m bis 3600 m zu finden.[3]
Ernährung
Die Art ist omnivor; sie ernährt sich vor allem von Samen, Gräsern und Kräutern, aber auch von heruntergefallenen Getreidekörnern sowie von Insekten. Die Nahrungszusammensetzung ist von der jahreszeitlich und regional bedingten Verfügbarkeit der verschiedenen Nahrungskomponenten abhängig. Sie haben dementsprechend eine proteinreiche Nahrungsperiode, in der viele Insekten gefressen werden, und eine proteinarme Periode mit viel pflanzlicher Nahrung. Während der Zeit proteinreicher Ernährung sind die Nieren vergrößert (Hypertrophie).[4]
Fortpflanzung
Morgenammern leben in einer monogamen Brutzeitpartnerschaft. Frische Gelege der tropischen Unterarten können zu jeder Jahreszeit gefunden werden; die Brutgipfel liegen in den Zeiten der zwei Sonnenwenden. Die beiden jährlichen Trockenzeiten rufen bei den Weibchen meist den Beginn der Mauser hervor und beenden die Legezeit. Dagegen haben die Männchen jährlich zwei viermonatige Fortpflanzungszeiten, denen jeweils eine zweimonatige Vollmauser folgt. Die Jungvögel werden gewöhnlich im Alter von fünf bis acht Monaten geschlechtsreif. Das Nest befindet sich am Boden oder nicht weiter als 60 cm vom Boden entfernt in Geröll, Büschen oder sehr niedrigen Bäumen. Es ist eine kompakte Schale aus Grashalmen, die im Inneren mit feinen Gräsern oder Haaren ausgepolstert ist. Das Gelege besteht aus drei bis vier auf blass grünlichblaun Grund intensiv braun gefleckten Eiern. Bei den in semiariden Gebieten lebenden Populationen der Morgenammer ist die Produktivität niedriger als bei denen, die in Regenwäldern leben.[5]
Die tropischen Unterarten der Morgenammer brüten in jedem Monat des Jahres, aber hauptsächlich zu den Zeiten der zwei Sonnenwenden. Die beiden jährlichen Trockenzeiten rufen bei den Weibchen meist den Beginn der Mauser hervor und beenden die Legezeit. Dagegen haben die Männchen jährlich zwei viermonatige Fortpflanzungszeiten, denen jeweils eine zweimonatige Vollmauser folgt. Die Jungvögel werden gewöhnlich im Alter von fünf bis acht Monaten geschlechtsreif.
.JPG.webp)
Glanzkuhstärlinge (Molothrus bonariensis) aus der Gattung der Kuhstärlinge (Molothrus) sind interspezifische Brutparasiten der Morgenammern, dabei wird das Nest des Wirtsvogels nicht nach der Körpergröße des Wirtsvogels, sondern nach der Eigenschaften des Nestbaus ausgewählt.[6]
Physiologie des Verhaltens
In einer Studie wurde gezeigt, dass innerhalb derselben Unterart die in Städten vorkommenden Morgenammern ein niedrigeres Körpergewicht, eine höhere Blutzuckerkonzentration, und weniger Lymphocyten haben, als die außerhalb von Städten lebenden Tiere.[7]
Die Morgenammer ist der einzige Art der Gattung, die in tropischen Gebieten brütet. Sie weist große Unterschiede in Bezug auf Stressantwort, Sexualdimorphismus und saisonalen Änderungen zu den nordamerikanischen Arten auf. Der Corticosteronspiegel wird saisonal moduliert und ist in der Zeit der Brut höher als in der Zeit der Mauser. Im Gegensatz zu den Arten der gemäßigten Klimazonen gibt es hier aber keine Geschlechtsunterschiede in der Sekretion der Corticosterone. Auch scheinen saisonale Unterschiede bei Z. capensis im Gegensatz zu den anderen Arten unabhängig von der Photoperiode zu sein.[8]
Ökologie

In Untersuchungen der zeitlichen Veränderungen der Gildenstruktur bestimmter Ansammlungen, in der zentralen Montewüste von Argentinien, wurden nach saisonalen Unterschieden in der Ressourcennutzung der dort ansässigen Vögel gesucht. Es wurde beschrieben, dass in diesem Gebiet Z. capensis mit der Braunsteißdiuca (Diuca diuca) eine Gilde bildet. Die beiden Arten sind unter den gegebenen Bedingungen vor allem Boden- und Blattnutzer. Es konnte keine bemerkenswerte saisonale Veränderung ihrer Nahrungssubstraten gezeigt werden, die Gilde bevorzugte während sowie außer der Brutsaison die unteren Bereiche der Vegetation.[3]
Bei in Chile lebenden Morgenammern wurde interspezifische Variabilität in Bezug auf ihre Energieproduktion und den Wassergehalt ihres Körpers untersucht. Die in den südlichen feuchteren Gebieten lebende Population zeigt eine höhere basale metabolische Rate als die in nördlicheren den semiariden Gebieten lebende Population. Morphologisch unterschiedliche Eigenschaften der nasalen Passage spielen eine Rolle bei der Verminderung der Evaporation bei der in semiariden Gebieten lebenden Population.[5]
Evolution
In Südamerika waren die Urformen der Morgenammer bereits vor dem Tertiär, vor mindestens 70 Millionen Jahren heimisch.[9]
James Bond behauptet, dass Z. capensis aus dem südlichen Amerika stammt,[10] er bezweifelt die Hypothese von Frank Michler Chapman, dass Z. capensis sich von Norden in Richtung Süden ausbreitete.[11] Sein Argument ist, dass wäre Chapmans Theorie richtig, so sei zu erwarten, dass sich die karibischen und in mittelamerikanischen Zonotrichia Arten stärker unterscheiden und es wären mehr Arten in Nordamerika zu erwarten. Dies ist aber nicht der Fall. Chapman war überzeugt, dass es eine postglaziale nach Süden gerichtete Ausbreitung gab, die zwischen 25.000 und 30.000 Jahre dauerte. Bond wendet ein, dass die Entstehung der vorhandenen geographischen Variation, die im südamerikanischen Verbreitungsgebiet Gebiete heute zu sehen ist, sich in so einer kurzen Zeitspanne, unwahrscheinlich ist. Auch Alexander Wetmore behauptet, dass nach dem Ende des Terziärs nur geringfügige Unterschiede in der Farbe und der Größe entstehen konnten.[12]
Die Artenentstehung innerhalb der Gattungen Zonotrichia und Melospiza passierte wahrscheinlich im Pleistozän, vor etwa 140.000 Jahren.[13]
Genetische Nachweise der Evolution der Morgenammer
Die Arten der Familie der Ammern (Emberizidae) zeigen das Phänomen der chromosomalen Reorganisationen (Translokation). Diese hat wahrscheinlich eine wesentliche Rolle bei der Evolution innerhalb der Familie gespielt hat.
Gezeigt wurden durch periozentrische Inversionen entstandene chromosomale Polymorphismen bei Z. albicollis (Chr.2 und Chr.3) und Z. capensis (Chr. 3 und Chr. 5). Intraspezifische und intrapopulationale Chromosomreorganisationen erklären vermutlich die Stetigkeit der Prozesse der Spezialisation.[14]
Systematik
Äußere Systematik
Die Gattung Zonotrichia besteht bisher aus fünf Arten. Die beiden Arten Z. leucophrys und Z. articapilla sind Schwesterarten. Danach folgen nach Verwandtschaft geordnet: Z. querula, Z. albicollis und Z. capensis. Die Morgenammer nimmt eine Sonderstellung ein, sie ist am weitesten von den anderen Arten entfernt und wurde 1929 von Robert Ridgway in die monotypische Gattung Brachyspiza gestellt.[15] Chapman stellte die Art 1940 dann zurück in die Gattung Zonotrichia. Er begründet dies vor allem mit den sehr ähnlichen Kopfmustern zu Z. albicollis und vielen weiteren morphologischen Ähnlichkeiten.[11] Weitere Untersuchungen bestätigten, dass Zonotrichia mit der Morgenammer monophyletisch ist. Die Verwandtschaft ist noch in folgendem Kladogramm dargestellt.[16]
| Zonotrichia |
| ||||||||||||||||||||||||
Innere Systematik
Bisher wurden 29 Unterarten beschrieben, die sich durch Färbung oder Gesang unterscheiden. Generell gilt, dass je südlicher in Südamerika die Unterart beheimatet ist, desto grauer ist der Kopf und desto weniger gestreift das Federkleid, während die Unterarten im Norden von Südamerika, vor allem in Venezuela, insgesamt dunkler sind.
| Z. c. antillarum (Riley, 1916) | Ähnlich Z. c. septentrionalis und Z. c. costaricensis aber die Flügelbänder sind im Gelbton schwächer, das schwarze Brustband ist geschlossen. Bevorzugt höhere Gebirge | Dominikanische Republik (Cordillera Central) |
| Z. c. antofagastae (Chapman, 1940) | Ähnlich Z. c. pulacayensis aber kleiner und meist insgesamt heller | Tarapacá und Antofagasta (Nordchile) |
| Z. c. arenalensis (Nores, 1986) | Argentinische Anden, brütet in Argentinien | |
| Z. c. australis (Latham, 1790) | Ähnlich Z. c. pulacayensis aber kleiner und meist insgesamt heller | Zugvogel der in Südchile eingetragen wurde, brütet in Argentinien bis Kap Hoorn, den Winter verbringt er in Bolivien |
| Z. c. bonnetiana (Stiles, 1995) | Südkolumbien (Caquetá) | |
| Z. c. capensis (Statius Muller, 1776) | Ähnlich Z. c. venezuelae, aber Haube und Hals zeigen weniger Schwarz. Zeigt auch Ähnlichkeit mit Z. c. subtorguata, aber die Flügelbinden sind weiß | Französisch-Guayana (südlich des Oyapock Flusses) und in Amapá (Brasilien) |
| Z. c. carabayae (Chapman, 1940) | Ähnlich Z. c. pulacayensis, aber viel dunkler, die schwarzen Streifen der Haube und die Rückenstrichel sind breiter. Ähnelt auch Z. c. peruviensis und Z. c. huancabambae, aber die Brust ist grauer und unten mehr gestreift | Ostanden in Peru (Junin) bis Westbolvien, brütet in Peru |
| Z. c. chilensis (Meyen, 1834) | Sehr ähnlich zu Z. c. choraules, aber generell dunkler und unten mehr gestreift; Haube und Brust sind grauer. Die Unterart ähnelt auch Z. c. sanborni, ist aber kleiner | Chile (Atacama bis Islas Guaitecas) und Argentinien, brütet in Argentinien und Chile |
| Z. c. choraules (Weltmore & Peters, 1922) | Ähnlich Z. c. chilensis, aber die Haube ist heller grau und die Streifen der Haube sind schmaler | Westargentinien (Mendoza, Neuquén und Rio Negro) |
| Z. c. costaricensis (Allen, JA, 1891) | Ähnelt am ehesten Z. c. septentrionalis, aber kleiner. Ähnlichkeiten zeigt sie auch mit Z. c. peruviensis, ist aber auch kleiner und gelbe Flügelbinden fehlen | Zugvogel, in den Bergen von Costa Rica bis Panama, Anden von Kolumbien bis Ecuador und Westvenezuela, brütet in Venezuela, Kolumbien und Ecuador, den Winter verbrachte er in Costa Rica |
| Z. c. huancabambae (Chapman, 1940) | Körpergröße ähnlich Z. c. costaricensis, aber Schnabel länger und generell heller. Kleiner als Z. c. peruviensis und das Gefieder ist weniger gestreift | endemische Art in Peru (Piura, Cajamarca, Amazonas, San Martin und Junin) |
| Z. c. hypoleuca (Todd, 1915) | Ähnelt Z. c. pulacayensis, ist aber kleiner und weniger gestreift. Ähnelt auch Z. c. subtorguata, aber hier sind die Flügelbinden nicht gelb, insgesamt heller | Ost- und Südbolivien und Argentinien |
| Z. c. illescasensis (Koepcke, 1963) | Nordperu (Cerro Illescas in Piura) | |
| Z. c. inaccessibilis (Phelps & Phelps, Jr, 1955) | Tepuis in Südvenezuela (Cerro de la Neblina) | |
| Z. c. insularis (Ridgway, 1898) | Hellste Unterart | Niederländische Antillen (Curacao und Aruba) |
| Z. c. macconelli (Sharpe, 1900) | Dunkelste Unterart, die Haube ist auch schwärzer die aller anderer Unterarten. Ähnelt Z. c. roraimae, ist aber größer und dunkler | Tepuis in Venezuela (Mt. Roraima)[17], brütet in Venezuela |
| Z. c. markli (Koepcke, 1971) | Nordküste Perus | |
| Z. c. matutina (Lichtenstein, MHK, 1823) | Ähnlich Z. c. capensis, aber generell heller, die Haube ist breiter und die schwarzen Streifen sind schmaler | Brasilien (Maranhao bis Bahia und Mato Grosso) und Bolivien, brütet in Brasilien |
| Z. c. mellea (Wetmore, 1922) | Ist Z. c. hypoleuca ähnlich, aber generell grauer | Zentralparaguay und Zentralargentinien (Formosa) |
| Z. c. novaesi (Oren, 1985) | Brasilien (Pará) | |
| Z. c. perezchinchillorum (W.H. Phelps Jr. & Aveledo, 1984) | Tepuis in Venezuela (Amazonas) | |
| Z. c. peruviensis (Lesson, 1834) | Größer als Z. c. huancabambae und kleiner der Z. c. pulacayensis. Die Brust ist weißer als bei Z. c. huancabambae und das Gefieder ist insgesamt grauer als bei Z. c. pulacayensis | Peru und in den Anden (La Libertad und Tacna) |
| Z. c. pulacayensis (Ménégaux, 1909) | Ist überwiegend gelbbraun, die gelben Flügelbinden fehlen | Anden in Peru (Junin), Bolivien und Argentinien, brütet in Argentinien |
| Z. c. roraimae (Chapman, 1929) | Schwarze Streifen der Haube breit, Schnabel länger als bei anderen Unterarten. Ähnlich Z. c. macconelli, aber kleiner und weniger dunkel | Südkolumbien (Meta) bis Venezuela, Guyana und Brasilien, brütet in Venezuela |
| Z. c. sanborni (Hellmayr, 1932) | Ähnlich Z. c. chilensis, aber größer und heller | Chilenische Anden (Coquimbo, Aconcagua) und Argentinien (San Juan) |
| Z. c. septentrionalis (Griscom, 1930) | Ähnelt farblich Z. c. costaricensis | Hochland in Mexiko (Chiapas) bis Guatemala, Honduras und El Salvador |
| Z. c. subtorguata (Swainson, 1837) | Gefieder oft mit olivem Farbton | Brasilien (Epirito Santo) bis Paraguay, Uruguay und Argentinien, brütet in Brasilien und Argentinien |
| Z. c. tocantinsi (Chapman, 1940) | Ähnlich Z. c. capensis aber weniger Schwarz am Hals | Brasilien (südliches Amazonasgebiet) |
| Z. c. venezuelae (Chapman, 1939) | Ähnlich Z. c. capensis aber am Hals mehr Schwarz | Venezuela |
Außerdem existieren noch die zwei Taxa Zonotrichia capensis orestera (Wetmore, 1951) und Zonotrichia capensis mellea (Wetmore, 1922), welche aber im Allgemeinen als ungültig betrachtet werden.
Gefährdung

Die International Union for Conservation of Nature and Natural Resources (IUCN) schätzt die Morgenammer mit allen Unterarten auf ihrer Roten Liste als „nicht gefährdet“ (least concern) ein.
Die globale Klimaveränderung beeinflusst auch das lokale Wetter, wie die Temperatur und den Regenfall, im Verbreitungsgebiet der Morgenammer. Diese Änderungen spiegeln sich im, für die Reproduktion und dem territorialen Verhalten dieser Vögel wichtigen, Gesang wider. Die Morgenammern singen einfach zur falschen Zeit. Dies kann zu erheblichen Störungen in den Populationen führen.[18]
Literatur
- J. F. Clements: The Clements checklist of birds of the world. 6. Auflage. Cornell University Press, Ithaca 2007, ISBN 978-0-8014-4501-9.
- H. C. B. Grzimek et al.: Vögel (= Grzimeks Tierleben. Enzyklopädie des Tierreiches. Band 9). Band 3. Deutscher Taschenbuch Verlag, München 1993, ISBN 3-463-16909-6.
- F. M. Chapman: The post-glacial history of Zonotrichia capensis. In: Bulletin of the American Museum of Natural History. Band 77. New York 1940, S. 1–15 (digitallibrary.amnh.org [PDF; 22,7 MB]).
- Araya M. Braulio, Millie H. Guillermo: Guia De Campo De las aves de Chile. 9. Auflage. Editorial Universitaria, Santiago de Chile 2005, ISBN 956-11-1764-9 (Erstausgabe: 1996).
Einzelnachweise
- Márcio F. Avelino, Jacques M.E. Vielliard: Comparative analysis of the song of the Rufous-collared Sparrow Zonotrichia capensis (Emberizidae) between Campinas and Botucatu, São Paulo State, Brazil. In: Anais da Academia Brasileira de Ciências. Band 76, Nr. 2, Juni 2004, S. 345–349, doi:10.1590/S0001-37652004000200023.
- Stephen C. Lougheed, P. Handford: Vocal Dialects and the Structure of Geographic Variation in Morphological and Allozymic Characters in the Rufous-Collared Sparrow, Zonotrichia capensis. In: Evolution. Band 46, Nr. 5, Oktober 1992, S. 1443–1456, doi:10.2307/2409948.
- J. L. de Casenave, V. R. Cueto, L. Marone: Seasonal dynamics of guild structure in bird assemblage of the central Monte desert. In: Basic and Applied Ecology. Band 9, 2008, S. 78–90 (bio.puc.cl [PDF; 342 kB] Volltext).
- Pablo Sabat, Esteban Sepúlveda-Kattan, Karin Maldonado: Physiological and biochemical responses to dietary protein in the omnivore passerine Zonotrichia capensis (Emberizidae). In: Comparative Biochemistry and Physiology. 2004, S. 391–396, doi:10.1016/j.cbpb.2003.10.021.
- P. Sabat, G. Cavieres, C. Vesolo, M. Canals: Water and energy economy of an omnivorous bird: Population differences in the Rufous-collared Sparrow (Zonotrichia capensis). In: Comparative Biochemistry and Physiology. Band 144, Nr. 4, 2006, S. 485–490, PMID 16750645.
- B. Mahler, V. A. Conifalonieri, I. J. Lovette, J. C. Reboreda: Partial host fidelity in nest selection by the shiny cowbird (Molothrus bonariensis), a highly generalist avian brood parasite. In: Journal of Evolutionary Biology. Band 20, Nr. 5, 2007, S. 1918–1923, PMID 17714308.
- G. Ruiz, M. Rosenmann, F. F. Novoa, P. Sabat: Hematological parameters and stress index in rufous-collared sparrows dwelling in urban environments. In: The Condor. Band 104, Nr. 1, 2002, S. 162–166, JSTOR:1370351 (Abstract).
- Haruka Wada, Ignacio T. Moore, Creagh W. Breuner, John C. Wingfield: Stress Responses in Tropical Sparrows: Comparing Tropical and Temperate Zonotrichia. In: Physiological and Biochemical Zoology. Band 79, Nr. 4, 2006, S. 784–792, doi:10.1086/505509.
- L. C. Chaley: La Biogeografia desde mi punto de vista. In: Atas del Congres. Latinoamericano de Zoologia. Band 1, xvi. Caracas 1983.
- James Bond: Origin of the Bird Fauna of the West Indies. In: The Wilson Bulletin. Band 60, Nr. 4, Dezember 1948, S. 207–229 (sora.unm.edu [PDF]).
- Frank Michler Chapman: The post-glacial history of Zonotrichia capensis. In: Bulletin of the American Museum of Natural History. Band 77. New York 1940, S. 1–15 (digitallibrary.amnh.org [PDF; 22,7 MB]).
- Alexander Wetmore: Development of our knowledge of fossil birds. In: F. M. Chapman, T. S. Palmer (Hrsg.): Fifty years progress of American ornithology, 1883–1933. American Ornithologists’ Union, Lancester 1933, S. 231–239.
- Robert M. Zink: Patterns of genic and morphologic variation among sparrows in the genera Zonotrichia, Melospiza, Junco, and Passerella. In: The Auk. Band 99, Nr. 4, Oktober 1982, S. 632–649, JSTOR:4086168 (Abstract).
- G. T. Rocha, E. J. De Lucca, E. B. De Souza: Chromosome polymorphism due to pericentric inversion in Zonotrichia capensis (Emberizidae-Passeriformes-Aves). In: Genetica. Band 80, Nr. 3, März 1990, S. 201–207, doi:10.1007/BF00137327.
- Robert Ridgway: Descriptions of Supposed New Genera, Species and Subspecies of American Birds. I. Fringillidae. In: The Auk. Band 15, Nr. 3, Juli 1898, S. 223–230, JSTOR:4068377 (Abstract).
- Michael A. Patten, Michael Fugate: Systematic Relationships among the Emberizid Sparrows. In: The Auk. Band 115, Nr. 2, April 1998, S. 412–424, JSTOR:4089200 (Abstract).
- Michael J. Braun, Mark B. Robins et al.: New Birds for Guyana from Mts Roraima and Ayanganna. In: British Ornithologists' Club. Band 123, Nr. 1, 2003, S. 24–34 (volltext [PDF; 531 kB]).
- Ignacio T. Moore, John C. Wingfield, Eliot A. Brenowitz: Plasticity of the Avian Song Control System in Response to Localized Environmental Cues in an Equatorial Songbird. In: The Journal of Neuroscience. Band 24, Nr. 45, 10. November 2004, S. 10182–10185, doi:10.1523/JNEUROSCI.3475-04.2004.
Weblinks
- Videos, Fotos und Tonaufnahmen zu Zonotrichia capensis in der Internet Bird Collection
- Beschreibung auf arthurgrosset.com (englisch)
- (Seite nicht mehr abrufbar, Suche in Webarchiven: Beschreibung) auf nfss.org (englisch)
- Video mit Gesang des Vogels
- Zonotrichia capensis in der Roten Liste gefährdeter Arten der IUCN 2011. Eingestellt von: BirdLife International, 2009. Abgerufen am 16. November 2011.
- Zonotrichia capensis bei Avibase
- Systematik und Erstbeschreibung der Arten der Gattung Zonotrichia mit Literaturhinweis
- Zonotrichia capensis im Integrated Taxonomic Information System (ITIS)
- xeno-canto: Tonaufnahmen – Rufous-collared Sparrow (Zonotrichia capensis)