Methylhypochlorit
Methylhypochlorit ist der Ester der hypochlorigen Säure und des Methanols. Er ist instabil und kann unter Freigabe von giftigen Dämpfen explodieren.[3] Die Instabilität der Verbindung wird von den oxidativen Eigenschaften der Hypochlorit-Gruppe verursacht. Es ist in der der Erdatmosphäre eine Quelle von Chlor.[5]
| Strukturformel | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|
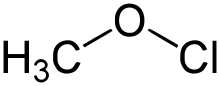 | ||||||||||
| Allgemeines | ||||||||||
| Name | Methylhypochlorit | |||||||||
| Summenformel | CH3ClO | |||||||||
| Kurzbeschreibung |
(unterhalb des Siedepunkts) gelbe Flüssigkeit[1] | |||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||
| ||||||||||
| Eigenschaften | ||||||||||
| Molare Masse | 66,48 g·mol−1 | |||||||||
| Aggregatzustand |
gasförmig | |||||||||
| Dichte |
1,1 g·cm−3[2] | |||||||||
| Siedepunkt | ||||||||||
| Brechungsindex |
1,343 (−20 °C)[2] | |||||||||
| Sicherheitshinweise | ||||||||||
| ||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | ||||||||||
Herstellung
Veresterung von hypochloriger Säure mit Methanol:
Es entsteht auch in der höheren Atmosphäre durch Reaktion von Methylperoxylradikalen CH3OO mit Chlormonoxid.[6]
Sicherheitshinweise
Bei Methylhypochlorit handelt es sich um eine instabile, leicht entflammbare, explosive Substanz. Die Verbindung ist ein Oxidationsmittel und als solches brandfördernd. Bei Kontakt mit Wasser zersetzt sich die Substanz der Veresterungsreaktion gemäß. Somit entstehen beim Einatmen ätzende Dämpfe, welche die Lungenbläschen angreifen. Auch zersetzt sich Methylhypochlorit unter bei hohen Temperaturen in folgenden Reaktionen:[7]
Einzelnachweise
- Traugott Sandmeyer: Ueber Aethyl- und Methylhypochlorit. In: Berichte der deutschen chemischen Gesellschaft. Band 19, Nr. 1, 1886, S. 857–861, doi:10.1002/cber.188601901196 (PDF).
- Carl L. Yaws: The Yaws Handbook of Physical Properties for Hydrocarbons and Chemicals Physical Properties for More Than 54,000 Organic and Inorganic Chemical Compounds, Coverage for C1 to C100 Organics and Ac to Zr Inorganics. Gulf Professional Publishing, 2015, ISBN 978-0-12-801146-1, S. 6 (eingeschränkte Vorschau in der Google-Buchsuche).
- Emil Abderhalden (Hrsg.): Biochemisches Handlexikon. I. Band, 1. Hälfte Kohlenstoff, Kohlenwasserstoffe, Alkohole der Aliphatischen Reihe, Phenole. Springer, 1911, ISBN 978-3-642-90817-0, S. 383, urn:nbn:de:1111-201202261673.
- Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- M. J. Krisch, L. R. McCunn, K. Takematsu, L. J. Butler, F. R. Blase, J. Shu: Photodissociation of CH3OCl to CH3O + Cl at 248 nm. In: The Journal of Physical Chemistry A. 108, 2004, S. 1650, doi:10.1021/jp0372082.
- Ulrich Platt, Jochen Stutz: Differential Optical Absorption Spectroscopy Principles and Applications. Springer Science & Business Media, 2008, ISBN 978-3-540-75776-4, S. 71 (eingeschränkte Vorschau in der Google-Buchsuche).
- Ian Priestley, Linda Young, Robert Mullins and Phillip Brown, Syngenta Process Hazards Group, Huddersfield, UK: THE THERMAL STABILITY OF ALKYL HYPOCHLORITES. (Nicht mehr online verfügbar.) IChemE, 2011, archiviert vom Original am 20. Mai 2016; abgerufen am 22. Mai 2016 (englisch). Info: Der Archivlink wurde automatisch eingesetzt und noch nicht geprüft. Bitte prüfe Original- und Archivlink gemäß Anleitung und entferne dann diesen Hinweis.