Duktales Karzinom in situ
Ein duktales Karzinom in situ (englisch ductal carcinoma in situ – DCIS) ist eine krankhafte Wucherung neoplastischer Zellen in den Milchgängen (Ductuli) der weiblichen Brust. Hierzu zählt auch das Paget-Karzinom (englisch: paget disease of the nipple, nach dem englischen Chirurgen James Paget), bei dem lediglich die Haut der Mamille infiltriert ist.
| Klassifikation nach ICD-10 | |
|---|---|
| D05.1 | Carcinoma in situ der Milchgänge |
| ICD-10 online (WHO-Version 2019) | |
Es handelt sich beim DCIS um entartete Zellen, die jedoch die Grenze des Milchgangs (Basalmembran) noch nicht durchbrochen haben („am Ort“, in situ). Ein solches Frühkarzinom ist immer heilbar, da es keine Tochterzellen ausstreut. Wenn der Tumor (Gewebsknoten) die Barriere in die Nachbarschaft durchbricht, nennt man das Wachstum invasiv. Große DCIS-Herde (> 2 cm) enthalten häufig invasive Bezirke, die nur bei minuziöser histologischer Aufbereitung aufgefunden werden. DCIS machen ca. 15 % aller Brustkarzinome aus.
Nicht alle dieser sog. In-situ-Brustkarzinome wachsen im Laufe der Erkrankung (Progress), ein Teil kann jedoch in ein invasives Karzinom übergehen. Das DCIS gilt deshalb als Krebsvorstufe (Präkanzerose).[1] Man schätzt, dass sich in einem Zeitraum von 10–20 Jahren etwa 50 % der in situ Karzinome zu invasiven Karzinomen entwickeln.[2] Da das DCIS im Gegensatz zum invasiven Brustkrebs bei vollständiger Entfernung zu nahezu 100 % heilbar ist, ist das Aufspüren dieser Präkanzerose ein erklärtes Ziel des Mammographie-Screenings. Die Veränderungen sollen rechtzeitig und vollständig entfernt werden, bevor ein invasives Brustkarzinom entsteht. Die Behandlung ist somit einerseits eine vorbeugende Maßnahme zur Vermeidung von Brustkrebs, andererseits erfolgt die operative Therapie, weil man durch die Mammographie allein eine Mikroinvasion (eine mikroskopisch kleine Invasion) nicht ausschließen kann.
Symptome
Das DCIS tritt in der überwiegenden Mehrheit der Fälle ohne Symptome auf und wird in der Regel erst im Rahmen einer Mammographie entdeckt. Seltene Symptome sind Schmerzen in der Brust, ein tastbarer Tumor oder eine blutige Sekretion aus der Brustwarze.
Diagnostik

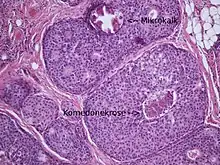
Duktale in situ Karzinome sind manchmal tastbar (sog. „tumorbildendes DCIS“), in den meisten Fällen können sie erst mit Hilfe der Mammographie entdeckt werden. Typisch sind sogenannte Mikrokalzifikationen, die vom Radiologen mit Hilfe einer Vakuumbiopsie punktiert werden können, um kleine (minimal invasive) Proben zu gewinnen. Eine Operation zur Diagnosesicherung ist deshalb nur selten (z. B. bei Lage unmittelbar an der Brustwand oder unter der Haut) nötig. Die histologische Untersuchung wird anschließend von einem Pathologen vorgenommen. Ein duktales in situ-Karzinom kann nur mit technischen Hilfsmitteln (Mammographie, Histologie) diagnostiziert werden, weil es mit bloßem Auge nicht sichtbar ist.
Das DCIS wird nach der WHO-Klassifikation der Tumoren anhand seiner Morphologie in drei Grade unterteilt: niedriger Kernmalignitätsgrad (low grade), mittlerer Kernmalignitätsgrad (intermediate grade) und hoher Kernmalignitätsgrad (high grade). Sie geben einen groben Anhaltspunkt für die Aggressivität des Tumors und werden mit Hilfe des Kerndurchmessers der Tumorzellen ermittelt.[3]
Je höher der Kerngrad, als desto aggressiver gilt der Tumor. Bei DCIS mit mittlerem oder hohem Kernmalignitätsgrad treten häufig auch sog. Komedonekrosen auf, welche verkalken können und so in der Mammographie sichtbar werden. Die Komedonekrosen werden als Zeichen eines schnellen Zellwachstums interpretiert.
Bei Vorliegen mehrerer unterschiedlicher Grade in einem Tumor wird stets der höchste Grad in der histologischen Diagnose angegeben.
Die Verschlüsselung nach TNM-Klassifikation ist Tis (Carcinoma in situ) mit dem Zusatz DCIS.
Therapie
Die Therapie des DCIS besteht aus einer operativen Entfernung im Gesunden, d. h. einer vollständigen Exzision mit ausreichenden Sicherheitsabständen zum gesunden Gewebe (S3-Leitlinien der Deutschen Krebsgesellschaft: 5 mm.[4] Europäische Leitlinien: 10 mm Sicherheitssaum[5]). In der Regel ist bei kleinen In-situ-Karzinomen (< 4 cm) eine brusterhaltende Operation möglich. Bei sehr großen Läsionen oder bei einem ungünstigen Tumor-Brust-Verhältnis wird eine Mastektomie (häufig mit zeitnahem plastisch-chirurgischem Wiederaufbau der betroffenen Brust) durchgeführt.
Eine Chemotherapie ist nicht notwendig. Eine generelle Empfehlung zur antihormonellen Behandlung des DCIS (z. B. durch Tamoxifen) besteht in den S3-Leitlinien nicht mehr. Lediglich bei DCIS vom hohen Kernmalignitätsgrad, jungen Patientinnen (< 50 Jahre) und befallenen Resektionsrändern ist ein Nutzen wissenschaftlich nachgewiesen, wobei der Nutzen unabhängig vom ermittelten Hormonrezeptorstatus ist.[6][7]
Prognose
Derzeit existieren noch keine zuverlässigen prognostischen Faktoren für das DCIS. Dies bedeutet, dass auch bei Kenntnis aller Merkmale der Erkrankung (z. B. Kerngrad und Größe) im individuellen Fall keine Vorhersage über den wahrscheinlichen Verlauf gemacht werden kann. Die wichtigsten Faktoren für die Entstehung eines Rezidivs sind das Lebensalter der Patientin (< 45 Jahre) und noch vorhandener Resttumor in der Brust nach Operation.[8][9][10][11] Die Vermeidung eines Rezidiv hat insofern Bedeutung, als dass 50 % aller DCIS-Rezidive als invasiver Brustkrebs auftreten.[12]
Bei vollständiger Entfernung mit ausreichenden Sicherheitsabständen ist die Prognose des DCIS ausgesprochen gut.
Van-Nuys-Prognose-Index
Der Van-Nuys-Prognose-Index (VNPI) wurde 1996 an der University of South California entwickelt. Grundlage war die Analyse der Daten von 706 Patientinnen mit DCIS, die brusterhaltend operiert worden waren. In den VNPI fließen der Kernmalignitätsgrad, die Größe des Tumors, das Alter der Patientin und der Abstand des DCIS vom Resektionsrand ein.[13]
Trotz seiner Bekanntheit wird der Van-Nuys-Prognose-Index heute kritisch gesehen, insbesondere, weil lediglich retrospektiv erhobene Daten und nicht Ergebnisse einer prospektiv randomisierten Studie vorliegen. Deshalb ist seine Anwendung zur Prognoseeinschätzung in den aktuellen S3-Leitlinien nicht empfohlen,[14] unter anderem auch deswegen, weil bei einer Operation immer eine Entfernung mit einem Sicherheitssaum von mindestens 5 mm erfolgen sollte, um einem Rezidiv vorzubeugen.[15]
Problematiken und aktueller wissenschaftlicher Stand
Das DCIS ist eine wissenschaftlich gesehen noch „neue“ Erkrankung, d. h. sie ist erst seit wenigen Jahrzehnten bekannt. Das häufige Auftreten (ca. 15 % aller bösartigen Brusterkrankungen) heutzutage ist vor allem auf das Mammographie-Screening zurückzuführen. Dieses bewirkt, dass das DCIS als Krebsvorstufe viel früher entdeckt wird, nämlich bevor ein invasives Wachstum, bzw. ein tastbarer Tumor vorliegt.
Bekannt ist, dass das Risiko, an Brustkrebs zu erkranken, bei einem duktalen In-situ-Karzinom im Vergleich zu einer gesunden Brust um das 8- bis 11-fache erhöht ist.[16] Dennoch entartet nicht jedes DCIS in ein invasives Karzinom. Da ein In-situ-Karzinom definitionsgemäß nicht metastasieren kann und somit nicht lebensbedrohlich ist, dient die Entfernung allein der Prävention von Brustkrebs.
Der aktuelle wissenschaftliche Stand spiegelt sich in den ärztlichen S3-Leitlinien (Medizinische Leitlinie mit der höchsten Qualitätsstufe) der Deutschen Krebsgesellschaft wider, welche in Zusammenarbeit von Gynäkologen, Radiologen, Pathologen, Onkologen und Patientenvertretern entstanden sind.[17]
Literatur
- Pathology and Genetics of Tumours of the Breast and Female Genital Organs (Who/IARC Classification of Tumours). 2003, ISBN 92-832-2412-4.
Weblinks
- Brusterkrankungen: Carcinoma in situ, Van-Nuys Prgnoseindex
- S3-Leitlinie Mammakarzinom der Dt. Krebsgesellschaft (Memento vom 18. Januar 2012 im Internet Archive) (PDF; 1,67 MB)
- European Guidelines for Quality Assurance in Breast Cancer Screening and Diagnosis (PDF; 2,4 MB)
- Leitfaden der Deutschen Krebsgesellschaft für betroffene Patientinnen (PDF; 578 kB)
Einzelnachweise
- HJ Burstein et al.: Ductal Carcinoma in situ of the Breast. In: N Engl J Med, 2004, 350, S. 1430–1441, doi:10.1056/NEJMra031301
- A. Lebeau: [Prognostic factors in ductal carcinoma in situ]. In: Der Pathologe. Band 27, Nummer 5, September 2006, S. 326–336, doi:10.1007/s00292-006-0853-y, PMID 16896676.
- Robert J. Rosser: Consensus conference on the classification of ductal carcinoma in Situ. In: Cancer. 82, 1998, S. 2293–2294, doi:10.1002/%28SICI%291097-0142%2819980601%2982:11%3C2293::AID-CNCR29%3E3.0.CO;2-O.
- S3-Leitlinie Mammakarzinom der Dt. Krebsgesellschaft (Memento vom 18. Januar 2012 im Internet Archive) (PDF; 1,67 MB) S. 232
- European Guidelines for Quality Assurance in Breast Cancer Screening and Diagnosis (PDF; 2,4 MB) S. 331
- J. Houghton, W. D. George, et al.: Radiotherapy and tamoxifen in women with completely excised ductal carcinoma in situ of the breast in the UK, Australia, and New Zealand: randomised controlled trial. In: Lancet. Band 362, Nummer 9378, Juli 2003, S. 95–102, PMID 12867108.
- S3-Leitlinie Mammakarzinom der Dt. Krebsgesellschaft (Memento vom 18. Januar 2012 im Internet Archive) (PDF; 1,67 MB) S. 33–34
- N. Bijker et al.: Breast-conserving treatment with or without radiotherapy in ductal carcinoma-in-situ: ten-year results of European Organisation for Research and Treatment of Cancer randomized phase III trial 10853 – a study by the EORTC Breast Cancer Cooperative Group and EORTC Radiotherapy Group. In: J Clin Oncol., 2006 Jul 20, 24(21), S. 3381–3387, PMID 16801628
- N. Bijker et al.: Risk factors for recurrence and metastasis after breast-conserving therapy for ductal carcinoma-in-situ: analysis of European Organization for Research and Treatment of Cancer Trial 10853. In: J Clin Oncol., 2001 Apr 15, 19(8), S. 2263–2271, PMID 11304780
- Kai C. Chan, W. Fiona Knox u. a.: Extent of excision margin width required in breast conserving surgery for ductal carcinoma in situ. In: Cancer. 91, 2001, S. 9–16, doi:10.1002/1097-0142%2820010101%2991:1%3C9::AID-CNCR2%3E3.0.CO;2-E.
- C. Vargas, et al.: Factors associated with local recurrence and cause-specific survival in patients with ductal carcinoma in situ of the breast treated with breast-conserving therapy or mastectomy. In: International journal of radiation oncology, biology, physics. Band 63, Nummer 5, Dezember 2005, S. 1514–1521, doi:10.1016/j.ijrobp.2005.04.045, PMID 16005576.
- W. Böcker: Preneoplesia of the Breast – An New Conceptual Approach to Proliferative Breast Disease. Elsevier, 2006, ISBN 0-7020-2892-4, S. 513.
- MJ Silverstein et al.: A prognostic index for ductal carcinoma in situ of the breast. Cancer. 1996 Jun 1, 77(11), S. 2267–2274, PMID 8635094.
- S3-Leitlinie Mammakarzinom der Dt. Krebsgesellschaft (Memento vom 18. Januar 2012 im Internet Archive) (PDF; 1,67 MB) S. 180
- S3-Leitlinie Mammakarzinom der Dt. Krebsgesellschaft (Memento vom 18. Januar 2012 im Internet Archive) (PDF; 1,67 MB) S. 28–29, S. 232
- WHO-Classification of Tumors: Pathology and Genetics of Tumours of the Breast and Female Genital Organs (Who/IARC 2003). ISBN 92-832-2412-4, S. 67.
- S3-Leitlinie Mammakarzinom der Dt. Krebsgesellschaft (Memento vom 18. Januar 2012 im Internet Archive) (PDF; 1,67 MB)