Magnesiumorthosilicat
Magnesiumorthosilicat ist eine chemische Verbindung des Magnesiums aus der Gruppe der Silicate.
| Kristallstruktur | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
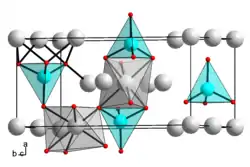 | ||||||||||||||||
| _ Mg2+ _ Si4+ _ O2− | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Magnesiumorthosilicat | |||||||||||||||
| Andere Namen |
Dimagnesiumsilicat | |||||||||||||||
| Verhältnisformel | Mg2SiO4 | |||||||||||||||
| Kurzbeschreibung |
weißer Feststoff[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 140,69 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest[1] | |||||||||||||||
| Dichte |
3,22 g·cm−3[1] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Löslichkeit |
praktisch unlöslich in Wasser[2] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Vorkommen
Magnesiumorthosilicat kommt natürlich in Form des Minerals Forsterit, Ringwoodit und Wadsleyit vor. Die Verbindung bildet mit dem Eisensilicat Fayalit (Fe2SiO4) eine vollständige Mischungsreihe innerhalb der Olivingruppe.[4] Sie ist in dieser Form ein Hauptbestandteil des Erdmantels.
Gewinnung und Darstellung
Magnesiumorthosilicat kann durch Reaktion von Magnesium mit Siliciumdioxidnanopartikeln bei 1100 °C in Argon gewonnen werden. Ebenfalls möglich ist die Darstellung durch Reaktion von Tetramethoxysilan oder Tetraethoxysilan mit Wasser und Magnesium in Methanol oder Sol-Gel-Prozess von Magnesiumnitrat mit kolloidem Siliciumdioxid.[5]
Eigenschaften
Magnesiumorthosilicat ist ein weißer Feststoff,[1] der praktisch unlöslich in Wasser ist.[2] Die Verbindung hat als häufigste Form (Forsterit) eine orthorhombische Kristallstruktur vom Olivintyp Raumgruppe Pnma (Raumgruppen-Nr. 62), Gitterparameter a=0,4756 nm, b=1,0197 nm, c = 0,5982 nm. Unter hohem Druck (Temperaturen über 1000 °C und Druck über 12 GPa) können jedoch auch noch zwei andere Modifikationen entstehen die auch bei Normalbedingungen stabil sind. Diese entsprechen den Mineralen Wadsleyit mit orthorhombischer Kristallstruktur und der Raumgruppe Imma (Raumgruppen-Nr. 74) und Ringwoodit mit kubischer Kristallstruktur und der Raumgruppe Fd3m (Raumgruppen-Nr. 227). Ab 33 GPa und 1000 °C zersetzt sich die Verbindung in Magnesiumoxid und Siliciumdioxid.[6][7]
Einzelnachweise
- Dale L. Perry: Handbook of Inorganic Compounds, Second Edition. CRC Press, 2016, ISBN 978-1-4398-1462-8, S. 257 (eingeschränkte Vorschau in der Google-Buchsuche).
- William M. Haynes: CRC Handbook of Chemistry and Physics, 94th Edition. CRC Press, 2016, ISBN 978-1-4665-7115-0, S. 73 (eingeschränkte Vorschau in der Google-Buchsuche).
- Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- Anna Hansen: Struktur und Stabilität der Silikate. GRIN Verlag, 2010, ISBN 978-3-640-57164-2, S. 4 (eingeschränkte Vorschau in der Google-Buchsuche).
- Harry G. Brittain: Profiles of Drug Substances, Excipients and Related Methodology. Academic Press, 2011, ISBN 978-0-12-387667-6, S. 281 (eingeschränkte Vorschau in der Google-Buchsuche).
- E. Yu Tonkov: High Pressure Phase Transformations Handbook 1. CRC Press, 1992, ISBN 978-2-88124-758-3, S. 543 (eingeschränkte Vorschau in der Google-Buchsuche).
- Surendra K. Saxena, Nilanjan Chatterjee, Yingwei Fei, Guoyin Shen: Thermodynamic Data on Oxides and Silicates An Assessed Data Set Based on Thermochemistry and High Pressure Phase Equilibrium. Springer Science & Business Media, 2012, ISBN 978-3-642-78332-6, S. 58 (eingeschränkte Vorschau in der Google-Buchsuche).