Lurasidon
Lurasidon (Handelsname: Latuda) ist ein Arzneistoff, der zur Behandlung der Schizophrenie sowie depressiver Phasen im Rahmen bipolarer Störungen angezeigt ist. Die Substanz ist ein atypisches Neuroleptikum und wurde durch die japanische Firma Dainippon Sumitomo Pharma entwickelt.
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
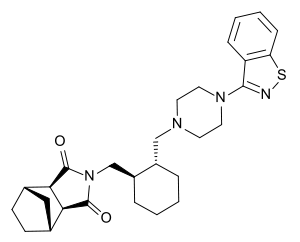 | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Freiname | Lurasidon | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C28H36N4O2S | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Arzneistoffangaben | |||||||||||||||||||
| ATC-Code |
N05AE05 | ||||||||||||||||||
| Wirkstoffklasse | |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 492,68 g·mol−1 | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
Die antipsychotische Wirkung von Lurasidon soll auf einer Blockade von D2- und 5-HT2A-Rezeptoren beruhen.[2] Im Tierexperiment konnte Lurasidon die negativen Auswirkungen des NMDA-Hemmstoffs MK-801 auf Gedächtnis und Lernfähigkeit von Ratten rückgängig machen.[3][4] Der Branchendienst Datamonitor sieht Lurasidon als eine weitere Variante atypischer Neuroleptika mit begrenztem therapeutischen Zusatznutzen.[5]
Latuda ist seit 2010 in den USA[6] und seit März 2014 in der EU zugelassen.[7][8] Mitte 2005 hatte Dainippon Sumitomo Lurasidon an die US-amerikanische MSD Sharp & Dohme auslizenziert. Merck zog sich jedoch schon 2006 wieder aus der Zusammenarbeit zurück. Danach führte Dainippon Sumitomo die Entwicklung wieder selbst durch.[9] In Deutschland wurde Lurasidon im März 2015 wieder vom Markt genommen.[10]
Siehe auch
Weblinks
Einzelnachweise
- Registrierungsdossier zu 4,7-Methano-1H-isoindole-1,3(2H)-dione, 2-[[(1R,2R)-2-[[4-(1,2-benzisothiazol-3-yl)-1-piperazinyl]methyl]cyclohexyl]methyl]hexahydro-, (3aR,4S,7R,7aS)- (Abschnitt GHS) bei der Europäischen Chemikalienagentur (ECHA), abgerufen am 7. Juli 2020.
- P. Cole, N. Serradell, E. Rosa, J. Bolos: Lurasidone hydrochloride. In: Drugs Fut. 33, 2008, S. 316–322.
- T. Ishiyama, K. Tokuda, T. Ishibashi u. a.: Lurasidone (SM-13496), a novel atypical antipsychotic drug, reverses MK-801-induced impairment of learning and memory in the rat passive-avoidance test. In: Eur J Pharmacol., 572, 2007, S. 160–70. PMID 17662268.
- T. Enomoto, T. Ishibashi, K. Tokuda u. a.: Lurasidone reverses MK-801-induced impairment of learning and memory in the Morris water maze and radial-arm maze tests in rats. In: Behav Brain Res., 186, 2008, S. 197–207. PMID 17881065.
- Pipeline Insight: Schizophrenia. (Memento vom 22. März 2014 im Internet Archive; PDF; 379 kB) Datamonitor, Juli 2006; abgerufen am 3. November 2008.
- FDA approves Latuda to treat schizophrenia in adults. U.S. FDA (Pressemitteilung), 28. Oktober 2010.
- Summary of opinion (initial authorisation). (PDF) 23. Januar 2014.
- Dainippon Sumitomo Pharma and Takeda Announce the European Marketing Authorization for Latuda® (lurasidone). PM von Takeda, 31. März 2014; abgerufen am 1. April 2014.
- Review of overseas development of Lurasidone (SM-13496), an atypical antipsychotic. (Memento vom 22. März 2014 im Internet Archive) Dainippon Sumitomo, 13. Dezember 2006; abgerufen am 1. November 2008.
- Marktrücknahmen im Zuge des AMNOG. In: akdae.de. 10. Dezember 2015.