Lucas-Probe
Die Lucas-Probe (auch Lucas-Test) ist eine Nachweisreaktion in der organischen Chemie zur Unterscheidung von primären, sekundären und tertiären Alkoholen. Dabei reagieren Alkohole abhängig von der Stellung der Hydroxygruppe im Molekül des Alkohols unter nucleophiler Substitution unterschiedlich schnell oder gar nicht. Da sich der Alkohol vollständig in dem zugegebenen Lucas-Reagenz lösen muss, ist der Test auf Alkohole mit weniger als sechs Kohlenstoffatomen beschränkt.[1]
Das Reagenz
Als Lucas-Reagenz – benannt nach Howard J. Lucas – wird eine Lösung von Zinkchlorid in konzentrierter Salzsäure bezeichnet; dabei ist die Salzsäure reaktiver Bestandteil und Zinkchlorid dient als Katalysator. Diese Mischung war bereits vor der Publikation seines Tests von Norris und Taylor.[2] für andere Zwecke benutzt worden, wie Lucas selbst schreibt.[3]
Durchführung

Zur Durchführung des Lucas-Tests werden einige Tropfen des zu testenden Alkohols in das Lucas-Reagenz gegeben und geschüttelt. Der Test ist positiv, wenn sich eine milchig-trübe Flüssigkeit bildet. Dies geschieht, in Abhängigkeit zur Position der Hydroxygruppe, unterschiedlich schnell:
- Primäre Alkohole: Reaktion nur durch Erhitzen der Probe[1]
- Beispiele: Ethanol oder 1-Propanol
- Sekundäre Alkohole: Reaktion innerhalb kurzer Zeit (etwa fünf Minuten)
- Beispiele: 2-Propanol oder 2-Butanol
- Tertiäre Alkohole: augenblickliche Reaktion
- Beispiel: 2-Methyl-2-propanol.
Die Reaktionszeit ist umso länger, je kleiner das Verhältnis von Reagenz zu Alkohol ist und je tiefer die Temperatur ist.
Erklärung
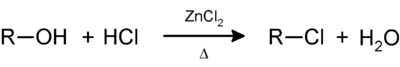
Niedermolekulare Alkohole lösen sich sehr gut in Wasser und auch im Lucas-Reagenz. Je nach Stellung der Hydroxygruppe reagieren die Alkohole mit dem Reagenz, indem die OH-Gruppe durch ein Chloratom substituiert wird. Die reaktionsträgen primären Alkohole reagieren nicht merklich, und die Lösung bleibt klar. Sekundäre Alkohole reagieren in wenigen Minuten, und der entstehende Chlorkohlenwasserstoff trübt zunächst die Lösung und scheidet sich dann als wasserunlösliche Phase ab. Die wesentlich reaktiveren tertiären Alkohole zeigen augenblicklich eine Trübung und Phasentrennung:
Ausnahmen
Eine Ausnahme bildet Allylalkohol, bei welchem die Reaktion – den tertiären Alkoholen gleich – sofort eintritt. Zudem ist das entstehende Allylchlorid im Lucas-Reagenz löslich, sodass die nötige Trübung ausbleibt.
Phenole geben ein negatives Ergebnis, da weder eine SN2-Reaktion – dies erfordert einen nucleophilen Angriff von der Rückseite, also aus dem Inneren des Ringes – noch SN1-Reaktion – ein Phenylkation wird unter diesen Bedingungen nicht gebildet – möglich ist.
Einzelnachweise
- Paula Y. Bruice und Thomas Lazar: Organische Chemie (2007), S. 502 ISBN 978-3-8273-7190-4.
- James F. Norris, Hazel B. Taylor, J. Am. Chem. Soc 46, 753–755 (1924).
- Howard J. Lucas, J. Am. Chem. Soc 52, 802–804 (1930).
Literatur
- Heinz G. O. Becker: Organikum: organisch-chemisches Grundpraktikum. 23. Auflage. Wiley-VCH, Weinheim 2009, ISBN 978-3-527-32292-3, S. 700 (bearbeitet von Rainer Beckert).
- Unterscheidung von primären, sekundären und tertiären Alkoholen. Lehramt Chemie – Dr. Reiß an der Philipps-Universität Marburg. (Zugriff am 27. Januar 2009)