Laurdan
Laurdan ist ein Fluoreszenzfarbstoff, der zur Untersuchung von Lipid Rafts in Zellmembranen verwendet wird.[2][3]
| Strukturformel | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
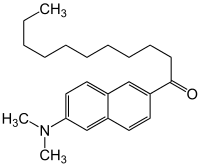 | |||||||||||||
| Allgemeines | |||||||||||||
| Name | Laurdan | ||||||||||||
| Andere Namen |
| ||||||||||||
| Summenformel | C24H35NO | ||||||||||||
| Kurzbeschreibung |
farbloser Feststoff[1] | ||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||
| |||||||||||||
| Eigenschaften | |||||||||||||
| Molare Masse | 353,54 g·mol−1 | ||||||||||||
| Aggregatzustand |
fest[1] | ||||||||||||
| Schmelzpunkt | |||||||||||||
| Sicherheitshinweise | |||||||||||||
| |||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||
Eigenschaften
Laurdan wird zur Färbung von Cholesterol-haltigen Bereichen der Zellmembranen (lipid rafts) eingesetzt.[4][5][6][7] Laurdan besitzt einen solvatochromen Effekt und ändert nach dem Anteil an Wassermolekülen in seiner Umgebung seine Farbe.[8][9]
Laurdan besteht aus einem Laurinsäureanteil mit einem Naphthalen verestert. Aufgrund einer teilweisen Ladungstrennung zwischen der 2-Dimethylamin- und der 6-Carbonylgruppe besitzt die Naphthalengruppe ein Übergangsdipolmoment, welches bei Anregung zunimmt und die Neuordnung der Moleküle des umgebenden Lösungsmittels verursacht. Dadurch entsteht die Fluoreszenz. Die Neuordnung des umgebenden Lösungsmittels benötigt Energie, die aus dem angeregten Zustand des Fluoreszenzfarbstoffs bezogen wird und sich bei wässrigen (polaren) Lösungsmitteln in einer Rotverschiebung des Emissionsspektrums äußert, bei apolaren Lösungsmitteln dagegen in einer Blauverschiebung. Laurdan besitzt in der Zellmembran ein Emissionsmaximum von 440 nm in der Gelphase und 490 nm in der flüssigen Phase. Diese Spektralverschiebung erfolgt durch die Relaxation, je nach Orientierung des Laurdans und der Neuordnung der umgebenden Lösungsmittelmoleküle.[10]
Anwendungen
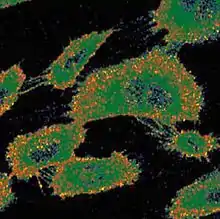
Laurdan kann an Zellen in Zellkultur angewendet werden. Durch die Einlagerung des Laurdan in Bereiche der Zellmembran kann auf deren Zusammensetzung rückgeschlossen werden.[11][12][13]
Geschichte
Laurdan wurde erstmals 1979 von Gregorio Weber synthetisiert.[14] Seine Dissertation mit dem Titel „Fluorescence of Riboflavin, Diaphorase and Related Substances“ war einer der Anfänge der Fluoreszenzspektroskopie von Biomolekülen.[14] Laurdan stellte eine Alternative zu Farbstoff-markierten Lipiden dar, welche oftmals unspezifische Wechselwirkungen des Farbstoffs mit der Zellmembran aufwiesen.[15] Laurdan wurde ursprünglich als Dipolrelaxationsfarbstoff für Zellmembranen entworfen.[16][17]
Weblinks
Einzelnachweise
- Datenblatt 6-Dodecanoyl-N,N-dimethyl-2-naphthylamine bei Sigma-Aldrich, abgerufen am 14. April 2014 (PDF).
- T Parasassi, Gratton E., Levi M.: Two-photon fluorescence microscopy of laurdan generalized polarization domains in model and natural membranes. In: Biophys. J. 72, Nr. 6, 1997, S. 2413–2429. bibcode:1997BpJ....72.2413P. doi:10.1016/S0006-3495(97)78887-8. PMID 9168019. PMC 1184441 (freier Volltext).
- D. M. Owen, Neil. M. A., Magee A. I.: Optical techniques for imaging membrane lipid microdomains in living cells. In: Cell Dev. Biol. 18, Nr. 5, 2007, S. 591–598. doi:10.1016/j.semcdb.2007.07.011.
- L. A. Bagatolli: To see or not to see: lateral organization of biological membranes and fluorescence microscopy. In: Biochim. Biophys. Acta. 1758, Nr. 10, 2006, S. 1451–1456. doi:10.1016/j.bbamem.2006.05.019.
- T. Parasassi, G. De Stasio, E. Gratton: Phase fluctuation in phospholipid membranes revealed by Laurdan fluorescence. In: Biophys. J. 57, Nr. 6, 1990, S. 1179–1186. bibcode:1990BpJ....57.1179P. doi:10.1016/S0006-3495(90)82637-0. PMID 2393703. PMC 1280828 (freier Volltext).
- L. J. Pike: Rafts defined: a report on the Keystone Symposium on Lipid Rafts and Cell Function. In: J. Lipid Res. 47, Nr. 7, 2006, S. 1597–1598. doi:10.1194/jlr.E600002-JLR200. PMID 16645198.
- S. A. Sanchez, M. A. Tricerri, E. Gratton: Laurdan generalized polarization: from cuvette to microscope. In: Modern Research and Educational Topics in Microscopy. 2007, S. 1007–1014.
- S. A. Gratton, M. A. Tricerri, E. Gratton.: Laurdan generalized polarization fluctuations measures membrane packing micro-heterogeneity in vivo. In: Proc. Natl. Acad. Sci. USA. 109, Nr. 19, 2012, S. 7314–7319. bibcode:2012PNAS..109.7314S. doi:10.1073/pnas.1118288109. PMID 22529342. PMC 3358851 (freier Volltext).
- P. Schneckenburger, M. Wagner, H. Schneckenburger.: Fluorescence imaging of membrane dynamics in living cells. In: J. Biomed. 15, Nr. 4, 2010, S. 6017. bibcode:2010JBO....15d6017W. doi:10.1117/1.3470446.
- P. Jurkiewicz, L. Cwiklik, P. Jungwirth, M. Hof: Lipid hydration and mobility: an interplay between fluorescence solvent relaxation experiments and molecular dynamics simulations. In: Biochimie. Band 94, Nummer 1, Januar 2012, S. 26–32, ISSN 1638-6183. doi:10.1016/j.biochi.2011.06.027. PMID 21740953.
- M Ingelmo-Torres, Gaus, K., Herms, A., Gonzalez-Moreno, E., Kassan, A.: Triton X-100 promotes cholesterol-dependent condensation of the plasma membrane. In: Biochem. J. 420, 2009, S. 373–381. doi:10.1042/BJ20090051.
- Use of laurdan fluorescence intensity and polarization to distinguish between changes in membrane fluidity and phospholipid order. In: Biochim Biophys Acta. 1565, 2002, S. 123. PMID 12225860.
- L.M Brignac-Huber, Reed, JR., Eyer, MK., Backes, WL.: Relationship between CYP1A2 Localization and Lipid Microdomain Formation as a Function of Lipid Composition. In: Drug Metab Dispos. 41(11), 2013, S. 1896–1905. doi:10.1124/dmd.113.053611. PMID 23963955.
- David M. Jameson: Gregorio Weber, 1916–1997: A Fluorescent Lifetime. In: Biophysical Journal (1998), Band 75, Ausgabe 1, S. 419–421. doi:10.1016/S0006-3495(98)77528-9.
- Alexander P Demchenko, Yves Mély, Guy Duportail, Andrey S. Klymchenko: Monitoring Biophysical Properties of Lipid Membranes by Environment - Sensitive Fluorescent Probes. In: Biophysical Journal. 96, Nr. 9, 6. Mai 2009, S. 3461–3470. doi:10.1016/j.bpj.2009.02.012.
- G. Weber, F. J. Farris: Synthesis and spectral properties of a hydrophobic fluorescent probe: 6 propionyl-2-(dimethylamino)naphthalene. In: Biochemistry. 18, 1979, S. 3075–3078.
- R. B. Macgregor, G. Weber: Estimation of the polarity of the protein interior by optical spectroscopy. In: Nature. 319, 1986, S. 70–73.