Larotrectinib
Larotrectinib (Handelsname: Vitrakvi) ist ein niedermolekularer hochselektiver Inhibitor der drei Tropomyosin-Rezeptor-Kinase-Proteine TRKA, TRKB und TRKC, die im Nervensystem im Bereich Schmerzregulierung, Propriozeption, Appetitsteuerung und Gedächtnis beteiligt sind. Larotrectinib ist zur tumorunabhängigen Therapie von TRK-Fusionstumoren zugelassen.
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
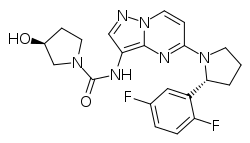 | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Freiname | Larotrectinib | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel | C21H22F2N6O2 | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 428,44 g·mol−1 | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Entwicklung
Es wurde erstmals von dem amerikanischen Biotech-Unternehmen Array BioPharma beschrieben und 2013 die Lizenz an Loxo Oncology übertragen. Die Markteinführung erfolgte unter dem Handelsnamen Vitrakvi durch Bayer.
Wirkung
Bei etwa einem Prozent aller soliden bösartigen Tumoren und in etwa 1000 Fällen jährlich in der gesamten Europäischen Union liegt ein Fusionsprotein vor, an dem eines der drei Gene der drei Tropomyosin-Rezeptor-Kinase-Proteine beteiligt ist. Die Gene heißen Neurotrophic receptor tyrosine kinase 1-3, abgekürzt NTRK 1-3, weshalb dann ein sog. NTRK-Fusionsprotein entsteht. Die TRK-Fusion führt zur Überexpression des zweiten Proteins, das dann dauerhaft und ligandenunabhängig den entsprechenden Signalweg aktiviert und ein malignes Wachstum auslösen kann. Daher wird auch von TRK-Fusionstumoren gesprochen.
Da das NTRK-Fusionsprotein bei verschiedenen Tumoren auftreten kann, wurde eine Analyse dreier offener prospektiver alters- und Tumortyp-unabhängiger (basket-studies) Studien durchgeführt, in die alle Patienten mit einem lokal fortgeschrittenen oder metastasierten, primär erfolglos mit Standardtherapie behandelten TRK-Fusionsprotein-positiven Tumor eingeschlossen wurden. Bei 55 Patienten, die zwischen 4 Monaten und 76 Jahren alt waren, und die 17 verschiedene Tumorarten hatten, zeigte sich eine Ansprechrate von 75 %. Nach einem Jahr zeigten noch 71 % ein Ansprechen und 55 % waren progressionsfrei. Kein Patient musste die Studie wegen unerwünschter Wirkungen abbrechen, die selten waren (5 % hatten Grad-3- oder -4-Wirkungen). Am häufigsten vertreten waren Speicheldrüsenkrebs, das infantile Fibrosarkom sowie andere Weichteilsarkome und Schilddrüsenkrebs, wobei kein Unterschied im Ansprechen zwischen den Tumorarten festgestellt werden konnte.[2]
Für die europäische Zulassung wurden Phase-I- und Phase-II-Studien mit insgesamt 122 Patienten gepoolt, die insgesamt ein hohes und lang anhaltendes Ansprechen bei Erwachsenen und Kindern zeigten. Die Ansprechrate lag bei 81 % über alle Altersgruppen nach medianen sieben bis achtzehn Monaten und bei Kindern bei 94 %. Bei den 34 Kindern, deren Daten in die Analyse einflossen, wurde in 35 % eine komplette Remission, bei 59 % eine partielle Remission und 6 % eine Stabilisierung beobachtet.[3]
Bisher sind dreißig solide Tumoren oder Sarkome bekannt, bei denen TRK-Fusionen nachgewiesen wurden. Die meisten gehören zu den Weichteilsarkomen, für die Larotrectinib bereits 2016 vorab als Orphan-Arzneimittel zugelassen worden war. Daneben finden sich TRK-Fusionsgene auch gelegentlich bei Speicheldrüsenkrebs und dem papillären Schilddrüsenkrebs sowie bei Gliomen. Auch für diese drei Tumorarten gab es eine Vorabzulassung.
Unerwünschte Wirkungen
Neben den typische Wirkungen einer Krebsimmuntherapie können bei Larotrectinib auch spezifische Wirkungen auftreten, die durch die Hemmung des TRK-Signalwegs bedingt sind, wie Gewichtszunahme, Schwindel, Ataxie und Parästhesien, da der TRK-Signalweg bei der Entwicklung und Aufrechterhaltung des Nervensystems beteiligt ist.[4]
Weitere TRK-Inhibitoren
Gleichzeitig mit Larotrectinib wurde auch Entrectinib durch die amerikanische Food and Drug Administration zugelassen, das ebenfalls ein TRK-Inhibitor der ersten Generation ist. Bei beiden wurden jedoch gelegentliche Resistenzen beobachtet. Daher wurden mit Selitrectinib und Repotrectinib zwei neue TRK-Inhibitoren der next generation entwickelt, die direkt an den Resistenzmechanismen ansetzen und in der klinischen Testphase sind.[4]
Zulassung
Larotrectinib wurde 2015 durch die amerikanische Arzneimittelbehörde Food and Drug Administration als Orphan-Arzneimittel anerkannt, zusätzlich wurde 2016 der Breakthrough-Therapiestatus (für besonders wirksame neue Arzneimittel) bewilligt für die Behandlung metastasierter solider Tumoren mit einem NTRK-Fusionsprotein. Die Marktzulassung für den US-Markt erfolgte im November 2018.[5]
Nach positivem Beschluss des Ausschusses für Humanarzneimittel (CHMP) der Europäischen Zulassungsbehörde (EMA) wurde Larotrectinib am 19. September 2019 durch die Europäische Kommission unter der Auflage an den Hersteller, weitere Studien zur Einschätzung der Risiken und unerwünschten Wirkungen durchzuführen, zugelassen.[6]
Diese Zulassung ist die erste mit einer tumor-unabhängigen Indikation, d. h. nicht für einen einzelnen Tumortypen, sondern für die gezielte Behandlung von TRK-Fusionstumoren. Die spezifische Behandlung eines onkogenen Treibers im betreffenden Tumorgenom wird auch als "Präzisionsonkologie" bezeichnet.[3]
Larotrectinib wurde als Monotherapie für TRK-Fusionstumoren zugelassen, die lokal fortgeschritten oder metastasiert sind, oder bei denen eine chirurgische Resektion mit einer erheblichen Morbidität einhergehen würde (wie eine Amputation), oder bei denen keine zufriedenstellende Therapieoption besteht.[3]
Einzelnachweise
- Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- Alexander Drilon, Theodore W. Laetsch, Shivaani Kummar, Steven G. DuBois, Ulrik N. Lassen, George D. Demetri, Michael Nathenson, Robert C. Doebele, Anna F. Farago, Alberto S. Pappo, Brian Turpin, Afshin Dowlati, Marcia S. Brose, Leo Mascarenhas, Noah Federman, Jordan Berlin, Wafik S. El-Deiry, Christina Baik, John Deeken, Valentina Boni, Ramamoorthy Nagasubramanian, Matthew Taylor, Erin R. Rudzinski, Funda Meric-Bernstam, Davendra P.S. Sohal, Patrick C. Ma, Luis E. Raez, Jaclyn F. Hechtman, Ryma Benayed, Marc Ladanyi, Brian B. Tuch, Kevin Ebata, Scott Cruickshank, Nora C. Ku, Michael C. Cox, Douglas S. Hawkins, David S. Hong, David M. Hyman u. a.: Efficacy of Larotrectinib in TRK Fusion–Positive Cancers in Adults and Children. New England Journal of Medicine 2018, Band 378, Ausgabe 8 vom 22. Februar 2018, Seiten 731–739, doi:10.1056/NEJMoa1714448
- Klaus Fleck: TRK-Fusionskrebs: Eine Arznei gegen viele Tumoren, Deutsches Ärzteblatt 2019, Jahrgang 116, Heft 44 vom 1. November 2019, Seite A2026, Link
- A. Drilon: TRK inhibitors in TRK fusion-positive cancers, Annals of Oncology 2019, Ausgabe 30, Supplement 8 vom 1. November 2019, Seiten viii23-viii30, [doi: 10.1093/annonc/mdz282]
- New Drug Application (NDA): 210861, abgerufen am 9. Februar 2019.
- Link zur EMA, abgerufen am 15. Dezember 2019, 01:12 Uhr CEST