Kyanäthin
Die alte Bezeichnung Kyanäthin (auch Cyanäthin) steht für 4-Amino-2,6-diethyl-5-methylpyrimidin. Es handelt sich dabei um die erste synthetisch erzeugte heterocyclische Verbindung.
| Strukturformel | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|
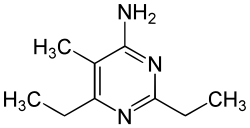 | ||||||||||
| Allgemeines | ||||||||||
| Name | Kyanäthin | |||||||||
| Andere Namen |
| |||||||||
| Summenformel | C9H15N3 | |||||||||
| Kurzbeschreibung |
weiß, geruchs- und fast geschmacklos[1] | |||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||
| ||||||||||
| Eigenschaften | ||||||||||
| Molare Masse | 165,24 g·mol−1 | |||||||||
| Schmelzpunkt | ||||||||||
| Siedepunkt |
280 °C (teilw. Zers.)[1] | |||||||||
| Löslichkeit |
löslich in Ethanol; in kaltem Wasser sehr wenig, in kochendem Wasser leichter löslich[1] | |||||||||
| Sicherheitshinweise | ||||||||||
| ||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||
Erzeugt wurde sie zuerst im Jahr 1848 von Hermann Kolbe und Edward Frankland im Laboratorium von Robert Bunsen durch Einwirkung von Propionitril (alte Bezeichnung: Cyanäthyl) auf elementares Kalium. Zunächst wurde dem Kyanäthin noch die falsche Summenformel C18H15N3 zugewiesen.[1] Die damaligen Untersuchungen waren Teil der Studien zur Radikaltheorie, trugen also zur Entwicklung der organischen Strukturchemie bei. Die Entdeckung des Kyanäthins fällt in die gleiche Zeit wie die des Diethylzink. Beiden Entdeckungen liegt die gleiche Idee zugrunde: Die Umsetzung eines Alkylhalogenids oder eines Alkylpseudohalogenids mit einem unedlen Metall. Die Reaktion von Propionitril und Kalium liefert hauptsächlich Ethan und Butan, das 4-Amino-2,6-diethyl-5-methylpyrimidin wird nur in kleinen Mengen gebildet. Es mag dieser Tatsache geschuldet sein, dass die Struktur weitgehend unbeachtet blieb.[3]
Die Trimerisierung von Nitrilen zu Pyrimidinen ist auch heute noch Teil der Forschung, wird aber inzwischen in weit besseren Ausbeuten mit Alkoxidbasen durchgeführt.[4]
Einzelnachweise
- F. Frankland, H. Kolbe: „Ueber die Zersetzungsproducte des Cyanäthyls durch Kalium“, in: Pharmaceutisches Centralblatt, Nr. 24, 31. Mai 1848, S. 369–375 (Volltext in der Google-Buchsuche).
- Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- E. von Meyer: „Ueber Kyanäthin und daraus hervorgehende neue Basen“, in: Journal für Praktische Chemie, 1880, 22, S. 261–288; doi:10.1002/prac.18800220118.
- Ian R. Baxendale, Steven V. Ley: „Formation of 4-Aminopyrimidines via the Trimerization of Nitriles Using Focused Microwave Heating“, in: J Comb Chem., 2005, 7 (3), S. 483–489; doi:10.1021/cc049826d.