Konode
Als Konoden (latein: con = zusammen, griech. οδός = Weg) bezeichnet man Linien, die in Phasendiagrammen thermodynamischer Systeme Zustandspunkte miteinander verbinden, die auf Phasengrenzlinien beziehungsweise Binodalen lokalisiert sind und die jeweils miteinander im thermodynamischen Gleichgewicht stehende koexistierende Phasen repräsentieren. Die koexistierenden Phasen können dabei in verschiedenen Aggregatszuständen vorliegen.[1] In Gemischen können die koexistierenden Phasen im selben Aggregatszustand vorliegen, jedoch verschiedene stoffliche Zusammensetzungen aufweisen.[2]
- Bei einem Gleichgewicht zwischen Feststoff und Gasphase:
- Der Schnittpunkt von Konode und Sublimationskurve gibt die Zusammensetzung des Feststoffes an.
- Der Schnittpunkt von Konode und Resublimationskurve gibt die Zusammensetzung der Gasphase an.
- bei einem Flüssigkeits-Gas-Gleichgewicht:
- Der Schnittpunkt von Konode und Siede-Kurve gibt die Zusammensetzung der Flüssigkeit an.
- Der Schnittpunkt von Konode und Kondensationskurve gibt die Zusammensetzung der Gasphase an.
- bei einem Fest-Flüssig-Gleichgewicht:
- Der Schnittpunkt von Konode und Solidus-Linie gibt die Zusammensetzung des Feststoffes an.
- Der Schnittpunkt von Konode und Liquidus-Linie gibt die Zusammensetzung der Schmelze an.
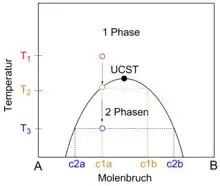
Gemische, deren Phasendiagramme Mischungslücken aufweisen, liegen innerhalb der Mischungslücken in Form koexistierender Phasen unterschiedlicher stofflicher Zusammensetzung vor. Die im Gleichgewicht stehenden Zustände, die die koexistierenden Phasen und deren stoffliche Zusammensetzung repräsentieren, liegen auf der Binodalen und werden durch Konoden verbunden.[3]
Da koexistierende Phasen miteinander im thermodynamischen Gleichgewicht stehen, müssen nach dem nullten Hauptsatz der Thermodynamik ihre Temperaturen sowie ihre Drücke (siehe Abschnitt Phasenregel für nicht chemisch reagierende Substanzen im Artikel Gibbssche Phasenregel)[4] gleich groß sein. Wird in einem Phasendiagramm, das ein Koexistenzgebiet enthält, entlang der x-Achse eine Zustandsgröße aufgetragen, in der sich die koexistierenden Phasen innerhalb des Koexistenzgebietes unterscheiden, während alle anderen das betrachtete System beschreibenden Zustandsgrößen in den koexistierenden Phasen die gleichen Werte annehmen, sind die Konoden parallel zur x-Achse orientiert. So sind Konoden in einem in die Druck-Volumen-Ebene projizierten Phasendiagramm eines fluiden Reinstoffes im Koexistenzgebiet zwischen flüssiger Phase und Gasphase parallel zur Volumenachse orientiert. In einem in die Temperatur-Zusammensetzungs-Ebene projizierten Phasendiagramm eines binären Gemisches, welches eine Mischungslücke als Koexistenzgebiet aufweist, sind die Konoden parallel zu derjenigen Achse orientiert, entlang derer die Zusammensetzung des Gemisches aufgetragen ist. Dies ist sowohl für Schmelz- und Siedediagramme der Fall als auch für Phasendiagramme, die Entmischung in kondensierten Systeme beschreiben. Die Volumen- beziehungsweise Stoffmengenanteile koexistierender Phasen lassen sich analog zum Hebelgesetz mittels der Konodenregel bestimmen. Wird jedoch eine Binodale in ein Dreiecksdiagramm projiziert, dass die Zusammensetzung eines ternären Gemisches darstellt, sind die Konoden in der Regel nicht parallel zu den Achsen des Dreiecksdiagramms orientiert.[5][6]
Literatur
- Bruno Predel, Michael Hoch, Monte Pool: Phase Diagrams and Heterogeneous Equilibria: a Practical Introduction. Springer-Verlag, Berlin/Heidelberg 2004, ISBN 978-3-662-09276-7, doi:10.1007/978-3-662-09276-7.
Einzelnachweise
- Peter W. Atkins, Julio de Paula: Physikalische Chemie. Aus dem Englischen von Michael Bär, Anna Schleitzer und Carsten Heinisch. 5. Auflage. Wiley-VCH, Weinheim 2013, ISBN 978-3-527-33247-2. Siehe Kapitel „5.3 Phasendiagramme von Zweikomponentensystemen“.
- Bruno Predel, Michael Hoch, Monte Pool: Phase Diagrams and Heterogeneous Equilibria: a Practical Introduction. Springer-Verlag, Berlin/Heidelberg 2004, ISBN 978-3-662-09276-7, Kapitel „3 Phase Equilibria in Two-Component Systems Under Exclusion of the Gas Phase.“, doi:10.1007/978-3-662-09276-7.
- J. B. Clarke, J. W. Hastie, L. H. E. Kihlborg, R. Metselaar und M. M. Thackeray: Definitions of terms relating to phase transitions of the solid state (IUPAC Recommendations 1994). In: Pure and Applied Chemistry. Band 66, Nr. 3, 1994, S. 577–594, doi:10.1351/pac199466030577.
- Kenneth Denbigh: The Principles of Chemical Equilibrium: With Applications in Chemistry and Chemical Engineering. 4. Auflage, Cambridge University Press, Cambridge 1981, ISBN 0-521-28150-4, doi:10.1017/CBO9781139167604, S. 184.
- Bruno Predel, Michael Hoch, Monte Pool: Phase Diagrams and Heterogeneous Equilibria: a Practical Introduction. Springer-Verlag, Berlin/Heidelberg 2004, ISBN 978-3-662-09276-7, Kapitel „4 Phase Equilibria in Three-Component Systems and Four-Component Systems with Exclusion of the Gas Phase“, doi:10.1007/978-3-662-09276-7.
- Burkhard Lohrengel: Thermische Trennverfahren: Trennung von Gas-, Dampf- und Flüssigkeitsgemischen. 3. Auflage. Walter de Gruyter, Berlin/Boston 2017, ISBN 978-3-11-047322-3, Kapitel „4.4.2 Teilweise Löslichkeit von Trägerstoff und Extraktionsmittel“.