Kaliumselenat
Kaliumselenat ist eine anorganische chemische Verbindung des Kaliums aus der Gruppe der Selenate.
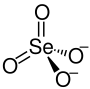
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Kaliumselenat | |||||||||||||||
| Andere Namen |
Kaliumorthoselenat | |||||||||||||||
| Summenformel | K2SeO4 | |||||||||||||||
| Kurzbeschreibung |
weißer geruchloser Feststoff[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 221,16 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest[1] | |||||||||||||||
| Dichte |
3,07 g·cm−3[1] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Löslichkeit |
114 g/l bei 25 °C[3] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Thermodynamische Eigenschaften | ||||||||||||||||
| ΔHf0 |
−1110 kJ·mol−1 [4] | |||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Gewinnung und Darstellung
Kaliumselenat kann man gewinnen, indem man Selendioxid mit einer gekühlten Kaliumhydroxidlösung reagieren lässt und das so gewonnene Kaliumselenit mit Brom im alkalischen Milieu oxidiert.[5]
Eigenschaften
Kaliumselenat ist ein weißer geruchloser Feststoff, der löslich in Wasser ist.[1] Von der Verbindung sind vier Modifikationen bekannt und besitzt bei Raumtemperatur eine orthorhombische Kristallstruktur mit der Raumgruppe Pnma (Raumgruppen-Nr. 62). Bei niedrigen Temperaturen unter 93 K liegt er in einer anderen, ferroelektrischen Modifikation vor (Raumgruppe Pna21 (Nr. 33)).[6] Bei einer Temperatur über 745 K geht er in eine hexagonale Kristallstruktur mit der Raumgruppe P63/mmc (Raumgruppen-Nr. 194) über.[7][2][8]
Verwendung
Kaliumselenat kann zur Herstellung von Selentrioxid verwendet werden.[9] Kaliumselenat wurde auch zur Behandlung von Selenmangel bei Nutztieren verwendet.[10][11]
Einzelnachweise
- Datenblatt Potassium selenate bei AlfaAesar, abgerufen am 15. Juni 2016 (PDF) (JavaScript erforderlich).
- Evgenii Tonkov: High Pressure Phase Transformations A Handbook. CRC Press, 1992, ISBN 978-2-88124-759-0, S. 518 (eingeschränkte Vorschau in der Google-Buchsuche).
- David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press/Taylor and Francis, Boca Raton, FL, Physical Constants of Inorganic Compounds, S. 4-83.
- M. Binnewies, E. Mike: Thermochemical Data of Elements and Compunds. 2. Auflage. Wiley-VCH, Weinheim 2002, ISBN 3-527-30524-6, Kap. 5, S. 645.
- Irene Rosenfeld, Orville A. Beath: Selenium Geobotany, Biochemistry, Toxicity, and Nutrition. Academic Press, 2013, ISBN 978-1-4832-7590-1, S. 305 (eingeschränkte Vorschau in der Google-Buchsuche).
- N. Yamada, Y. Ono, T. Ikeda: A Structural Study of the Incommensurate-to-Ferroelectric Phase Transition in K2SeO4. In: Journal of the Physical Society of Japan, 53, 1984, S. 2565–2574, doi:10.1143/JPSJ.53.2565.
- N. Ohama: Superstructure of potassium selenate K2SeO4. In: Materials Research Bulletin. 9, 1974, S. 283, doi:10.1016/0025-5408(74)90078-6.
- A. Kálmán, J. S. Stephens, D. W. J. Cruickshank: The crystal structure of K2SeO4. In: Acta Crystallographica Section B Structural Crystallography and Crystal Chemistry. 26, S. 1451, doi:10.1107/S0567740870004314.
- Hermann Sicius: Chalkogene: Elemente der sechsten Hauptgruppe Eine Reise durch das Periodensystem. Springer-Verlag, 2015, ISBN 978-3-658-10522-8, S. 28 (eingeschränkte Vorschau in der Google-Buchsuche).
- und Nutztieren: Begründet von W. Löscher, F.R ...: Pharmakotherapie bei Haus- und Nutztieren Begründet von W. Löscher, F.R. Ungemach und R. Kroker. Georg Thieme Verlag, 2014, ISBN 3-8304-1252-5 (eingeschränkte Vorschau in der Google-Buchsuche).
- Eintrag zu Kaliumselenat bei Vetpharm, abgerufen am 15. Juni 2016.


