Kaliumdiphosphat
Kaliumdiphosphat ist eine anorganische chemische Verbindung des Kaliums aus der Gruppe der Diphosphate die normalerweise als Trihydrat vorliegt.
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
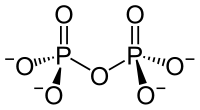 | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Kaliumdiphosphat | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel | K4P2O7 | |||||||||||||||
| Kurzbeschreibung |
weißer Feststoff[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 330,34 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest[1] | |||||||||||||||
| Dichte |
2,61 g·cm−3[1] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Löslichkeit | ||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Gewinnung und Darstellung
Kaliumdiphosphat kann durch Dehydration von Dikaliumhydrogenphosphat bei 350 – 400 °C gewonnen werden.[4]
Ebenfalls möglich ist die Gewinnung durch Reaktion von Kaliumcarbonat mit Phosphorpentoxid.[5]
Eigenschaften
Kaliumdiphosphat ist ein weißer hygroskopischer Feststoff, der sehr leicht löslich in Wasser ist.[1] Das Trihydrat wandelt sich bei 180 °C zum Monohydrat und bei 330 °C in das Anhydrat um.[2]
Verwendung
Kaliumdiphosphat wird in Textilhilfsmitteln zur Verhütung von Härte-Niederschlägen, als Seifenzusatz, zur kathodischen Abscheidung von Zinn oder Zinn-Gold-Legierungen, zur Wasserstoffperoxid-Stabilisierung, zur Tonreinigung und bei Erdölbohrungen verwendet.[3]
Einzelnachweise
- Eintrag zu Kaliumdiphosphat in der GESTIS-Stoffdatenbank des IFA, abgerufen am 10. Januar 2017. (JavaScript erforderlich)
- Dale L. Perry: Handbook of Inorganic Compounds. CRC Press, 1995, ISBN 978-0-8493-8671-8, S. 315 (eingeschränkte Vorschau in der Google-Buchsuche).
- Eintrag zu Kaliumphosphate. In: Römpp Online. Georg Thieme Verlag, abgerufen am 17. Januar 2015.
- Arthur D. F. Toy: The Chemistry of Phosphorus: Pergamon Texts in Inorganic Chemistry. Elsevier, 2013, ISBN 978-1-4831-4741-3, S. 513 (eingeschränkte Vorschau in der Google-Buchsuche).
- Govindhan Dhanaraj, Kullaiah Byrappa, Vishwanath Prasad, Michael Dudley: Springer Handbook of Crystal Growth. Springer Science & Business Media, 2010, ISBN 978-3-540-74761-1, S. 740 (eingeschränkte Vorschau in der Google-Buchsuche).
