Kaliumamid
Kaliumamid ist eine chemische Verbindung aus der Gruppe der Amide.
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
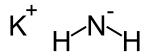 | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Kaliumamid | |||||||||||||||
| Summenformel | KNH2 | |||||||||||||||
| Kurzbeschreibung |
weißes bis graues Pulver mit Geruch nach Ammoniak[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 55,12 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||
| Dichte |
1,57 g·cm−3[2] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Löslichkeit |
reagiert mit Wasser[1] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Gewinnung und Darstellung
Kaliumamid kann durch Reaktion von Kalium mit Ammoniak gewonnen werden.[4]
Es wurde zuerst 1808 von Joseph Louis Gay-Lussac und Louis Jacques Thénard dargestellt.[5]
Eigenschaften
Kaliumamid ist ein weißes bis graues hygroskopisches Pulver mit Geruch nach Ammoniak, das mit Wasser reagiert.[1][2] Es besitzt eine monokline Kristallstruktur mit der Raumgruppe P21/m (Raumgruppen-Nr. 11).[6] Es zersetzt sich an feuchter Luft, wobei sich Ammoniak und Kaliumhydroxid bilden.[2]
Verwendung
Kaliumamid wird in der organischen Chemie (z. B. für nukleophile Substitutionen und Polymerisationen) verwendet.[7]
Einzelnachweise
- Alkalimetals: MSDS (Memento des Originals vom 4. März 2016 im Internet Archive) Info: Der Archivlink wurde automatisch eingesetzt und noch nicht geprüft. Bitte prüfe Original- und Archivlink gemäß Anleitung und entferne dann diesen Hinweis. (PDF; 27 kB)
- Jean D'Ans,Ellen Lax: Taschenbuch für Chemiker und Physiker. 2007, ISBN 978-3-540-60035-0, S. 510 (eingeschränkte Vorschau in der Google-Buchsuche).
- Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- R. Abegg, F. Auerbach: 'Handbuch der anorganischen Chemie'. Verlag S. Hirzel, Bd. 2, 1908. S. 368.Volltext
- Sächsische Akademie der Wissenschaften: Chronologie der Naturwissenschaften. 2002, ISBN 978-3-8171-1610-2, S. 364 (eingeschränkte Vorschau in der Google-Buchsuche).
- R. Juza, H. Jacobs, W. Klose: Die Kristallstrukturen der Tieftemperaturmodifikationen von Kalium- und Rubidiumamid. In: Zeitschrift für anorganische und allgemeine Chemie. 338, 1965, S. 171–178. doi:10.1002/zaac.19653380309.
- Karl-Heinz Lautenschläger, Werner Schröter, Andrea Wanninger: Taschenbuch der Chemie. 2007, ISBN 978-3-8171-1760-4, S. 286 (eingeschränkte Vorschau in der Google-Buchsuche).
This article is issued from Wikipedia. The text is licensed under Creative Commons - Attribution - Sharealike. The authors of the article are listed here. Additional terms may apply for the media files, click on images to show image meta data.