Jones-Oxidation
Die Jones-Oxidation ist eine chemische Reaktion der Organischen Chemie, die der Oxidation von Alkoholen und Aldehyden dient. Primäre Alkohole werden hierbei zunächst zu Aldehyden, dann zu Carbonsäuren oxidiert, sekundäre Alkohole zu Ketonen. Als Oxidationsmittel dient Chrom(VI)-oxid, das zu Chrom(IV) reduziert wird, und anschließend zu Chrom(III) und Chrom(VI) disproportioniert. Die Reaktion wird in konzentrierter Schwefelsäure meist in Anwesenheit von Aceton (Jones-Reagenz) durchgeführt. Im Gegensatz zur Swern-Oxidation und zur Dess-Martin-Oxidation muss der eingesetzte Alkohol in stark saurem Medium beständig sein.
Die Reaktion wurde von dem britischen Chemiker Ewart Jones (1911–2002) eingeführt.
Übersichtsreaktion
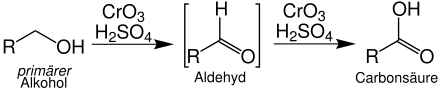
Primäre Alkohole werden über die Stufe der zumeist nicht isolierbaren Aldehyde zu Carbonsäuren oxidiert:
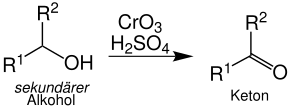
Sekundäre Alkohole werden zu Ketonen oxidiert. Die Organylreste R1 und R2 können gleich oder verschieden sein:
Mechanismus
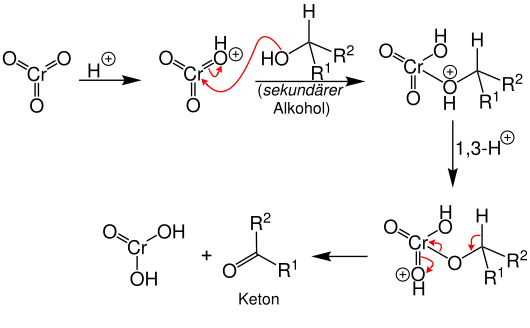
Der Mechanismus der Jones-Oxidation ist nicht vollständig aufgeklärt. Der hier angegebene Mechanismus ist nur eine von mehreren denkbaren Möglichkeiten. Das Chromtrioxid wird zunächst durch die Schwefelsäure protoniert und reagiert dann mit dem Alkohol (im Beispiel ein sekundärer Alkohol) zu einem Oxoniumion. Das Oxoniumion lagert sich durch eine 1,3-Protonenverschiebung um. Der Alkohol wird deprotoniert und es kommt zur α-H-Eliminierung unter Abspaltung der Chromspezies und Bildung eines Ketons.[1]
Verwendung
Die Jones-Oxidation kann lediglich zur Synthese von Ketonen und Säuren eingesetzt werden; das Anhalten der Reaktion auf der Stufe des Aldehyds ist nicht möglich. Im Substrat vorhandene Doppelbindungen werden meist nicht angegriffen.
Kritik
Die Jones-Oxidation ist ein Laborverfahren und wird nur selten in der Industrie verwendet, da Chrom(VI)-oxid sehr giftig, cancerogen und mutagen ist, und die entstandenen Chromabfälle außerdem aufwendig entsorgt werden müssen. Außerdem zählt die Jones-Oxidation zu den Reaktionen geringer Atomökonomie, da das Mengenverhältnis zwischen Zielverbindung (Carbonsäure oder Keton) und Abfallstoffen sehr ungünstig ist.
Quellen
- Kenneth Bowden, I. M. Heilbron, E. R. H. Jones, B. C. L. Weedon: Researches on acetylenic compounds. Part I. The preparation of acetylenic ketones by oxidation of acetylenic carbinols and glycols. In: Journal of the Chemical Society (Resumed). 1946, S. 39–45, doi:10.1039/JR9460000039.
- Reinhard Brückner: Reaktionsmechanismen. 3. Auflage. Elsevier, München 2004, ISBN 3-8274-1579-9, S. 742 f.
Einzelnachweise
- Zerong Wang: Comprehensic Organic Name Reactions and Reagents, Volume 2, Wiley, 2009, S. 1564–1568, ISBN 978-0-471-70450-8.