Iwanow-Reaktion
Die Iwanow-Reaktion, auch Ivanov-Reaktion, ist eine Namensreaktion in der Organischen Chemie und nach dem bulgarischen Chemiker Dimitr Iwanow (1894–1975) benannt. Er beschrieb diese Reaktion erstmals 1931.
Übersichtsreaktion
Bei der Iwanow-Reaktion wird über eine Grignard-Verbindung eine Bindung zu einem Elektrophil in α-Position hergestellt. Als Rest (R) können Aryl- und Phenylgruppen fungieren. Des Weiteren werden als Elektrophil (E) hauptsächlich Aldehyde und Ketone eingesetzt.[1]
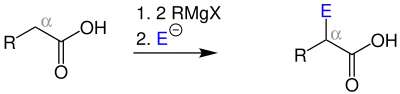
Allgemeines
Die Reaktion hat je nach Verfahren Ausbeuten von 60 % bis 91 %. Es entstehen dabei zwei Diastereomere, welche chromatographisch an einer stationären Phase von Kieselgel getrennt werden konnten. Dabei wurde herausgefunden, dass ein Diastereomer zu 76 % mit einem Schmelzpunkt von 178 °C und das andere nur zu 24 % mit einem Schmelzpunkt von 143 °C gewonnen werden konnte.[2]
Reaktionsmechanismus
Zunächst wird ein Dianion bzw. das so genannte Iwanow-Reagenz aus Aryl-Essigsäure hergestellt. Dabei findet eine elektrophile Reaktion mit der Grignard-Verbindung statt (1). Hierdurch entsteht eine weitere Carbonylgruppe, welche wiederum auch elektrophil mit einer Grignard-Verbindung reagiert (2). Es entsteht das Iwanow-Reagenz, welches eher einen Ionencharakter von der Bindung her zum Magnesium darbietet (Dianion).


Das Iwanow-Reagenz reagiert mit Elektrophilen, vorzugsweise Carbonylverbindungen (Aldehyde, Ketone), Isocyanaten oder Alkylhalogeniden.[3][4][5][6][7] Im folgenden Beispiel wird das Iwanow-Reagenz aus Phenylessigsäure und zwei Äquivalenten einer Grignard-Verbindung hergestellt. Als Elektrophil wird Benzaldehyd (blau markiert) eingesetzt. In 3 findet ein elektrophiler Angriff des Aldehyds auf die Doppelbindung des Iwanow-Reagenz statt, wobei sich durch Umklappen der Elektronen das Magnesium an den Sauerstoff des Benzaldehyds bindet (4). Durch Hydrolyse wird das Endprodukt 5 erhalten.
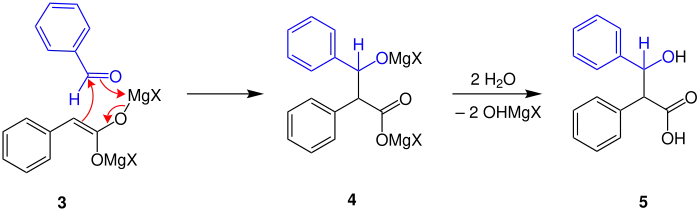
Stereoselektivität
Bei der Iwanow-Reaktion entstehen 2 Diastereomere. Diese entstehen im Verhältnis 76:24. Grund hierfür ist die Sterische Hinderung der Phenylgruppe(n). Diese sterische Hinderung der Iwanow-Reaktion wurde von Zimmermann und Traxler über einen nach ihnen benannten Zimmermann-Traxler-Übergangszustand beschrieben. Toullec et al. haben die Kinetik der Reaktion untersucht.[8][9] Die Stereozentren wurden mit roten Sternchen in der Abbildung markiert.
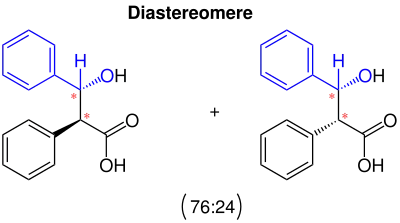
Siehe auch
Literatur
- Bradford P. Mundy, Michael G Ellerd, Frank G. Favaloro Jr.: Name Reactions and Reagents in Organic Syntheses, second Edition, Wiley-Interscience, 2005, S. 342, ISBN 0-471-22854-0.
- The Merck Index, 9. Auflage, Merck & Co. 1976, ONR-(noch eintragen), ISBN 0-911-91026-3
- Reinhard Brückner: Reaktionsmechanismen, 3. Auflage, Spektrum Akademischer Verlag, 2004, S. 556–559
Einzelnachweise
- Bradford P. Mundy, Michael G Ellerd, Frank G. Favaloro Jr.: Name Reactions and Reagents in Organic Syntheses, 2. Auflage, Wiley-Interscience, 2005, S. 342, ISBN 0-471-22854-0.
- Howard E. Zimmerman, Marjorie D. Traxler: Journal of the American Chemical Society. Band 79, 1957, S. 1920–1923, doi:10.1021/ja01565a041.
- D. Ivanov, A. Spassoff: Bulletin de la Société chimique de France, 4e sér. Band 49, 1931, S. 19.
D. Ivanov, A. Spassoff: Bulletin de la Société chimique de France, 4e sér. Band 49, 1931, S. 375. - D. Ivanov et al.: Bulletin de la Société chimique de France, 4e sér. Band 51, 1932, S. 1321.
D. Ivanov et al.: Bulletin de la Société chimique de France, 4e sér. Band 51, 1932, S. 1325.
D. Ivanov et al.: Bulletin de la Société chimique de France, 4e sér. Band 51, 1932, S. 1331. - B. Blagoev, D. Ivanov: Syntheses with Polyfunctional Organomagnesium Compounds. In: Synthesis. Band 1970, Nr. 12, 1970, S. 615–627, doi:10.1055/s-1970-21652.
- D. Ivanov, G. Vassilev, I. Panayotov: Syntheses and Reactions of Organolithium Reagents Derived from Weakly Acidic C-H-Compounds. In: Synthesis. Band 1975, Nr. 2, 1975, S. 83–98, doi:10.1055/s-1975-23669.
- C. R. Hauser, W. R. Dunnavant: α,β-Diphenylpropionic Acid In: Organic Syntheses. 40, 1960, S. 38, doi:10.15227/orgsyn.040.0038; Coll. Vol. 5, 1973, S. 526 (PDF).
- Jean Toullec, Margarita Mladenova, Francoise Gaudemar-Bardone, Balgoi Blagoev: Kinetics and mechanism of the Ivanov reaction: reaction of aldehydes and ketones with phenylacetic acid magnesium enediolate. In: The Journal of Organic Chemistry. Band 50, Nr. 14, 1. Juli 1985, S. 2563–2569, doi:10.1021/jo00214a030.
- Reaktionsmechanismen, Reinhard Brückner, 3. Auflage, Spektrum Akademischer Verlag, 2004, S. 556.