Ingenolmebutat
Ingenolmebutat ist eine in der Garten-Wolfsmilch (Euphorbia peplus) vorkommende Substanz aus der chemischen Gruppe der Diterpene. Sie ist als Arzneistoff zur topischen Behandlung der aktinischen Keratose einsetzbar, einer durch intensive Einwirkung von UV-Strahlung verursachten Hauterkrankung und Präkanzerose. In den USA ist ein ingenolmebutathaltiges Gel seit Januar 2012 zugelassen.[2] In der Europäischen Union bestand eine Zulassung vom November 2012 bis zum Februar 2020. Aufgrund eines erhöhten Hautkrebsrisikos wird das Nutzen-Risiko-Verhältnis als negativ beurteilt.
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
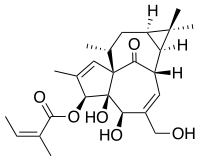 | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Freiname | Ingenolmebutat | |||||||||||||||||||||
| Andere Namen |
| |||||||||||||||||||||
| Summenformel | C25H34O6 | |||||||||||||||||||||
| Kurzbeschreibung |
amorphe Substanz[1] | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||||||||
| ATC-Code |
D06BX02 | |||||||||||||||||||||
| Wirkstoffklasse |
Antineoplastikum | |||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 430,53 g·mol−1 | |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||||||||
Vorkommen und Wirkung
.jpg.webp)
Ingenolmebutat gehört zu den Estern einer Gruppe von Diterpenen (Ingenane, Tigliane, Daphnane), die eine wichtige Rolle für die Ätiologie der Tumorentstehung spielen.[3]
Ingenolmebutat wird an zwei (Stamm, Extremitäten) bzw. drei (Gesicht, Kopfhaut) aufeinanderfolgenden Tagen jeweils einmal auf den betroffenen Hautstellen aufgetragen und führt dort zu einer epidermalen Nekrose. Der genaue Wirkungsmechanismus ist nicht bekannt. In-vivo- und In-vitro-Versuche deuten auf einen dualen Mechanismus hin: zum einen eine direkte zytotoxische Wirkung und zum anderen eine Förderung einer Entzündungsreaktion durch die örtlich begrenzte Produktion von proinflammatorischen Zytokinen und Chemokinen und durch Einwanderung von immunkompetenten Zellen. Als unerwünschte Wirkungen wurden sehr häufig (d. h. bei mehr als 10 Prozent der Behandelten) lokale, darunter auch schwere, Hautreaktionen an der Anwendungsstelle wie Erythem, Exfoliation, Schorf, Schwellungen und Pusteln beobachtet.[4]
Frühe Nutzenbewertung
In Deutschland müssen sich seit 2011 neu zugelassene Medikamente mit neuen Wirkstoffen aufgrund § 35a SGB V (AMNOG) einer „frühen Nutzenbewertung“ durch den Gemeinsamen Bundesausschuss (G-BA) unterziehen. Dabei wird in einem in der Verfahrensordnung festgelegten Prozess der Zusatznutzen gegenüber einer „zweckmäßigen“ Vergleichstherapie bewertet. Der G-BA stellt dann in einem Beschluss den Grad des Zusatznutzens fest. Darauf basierend handeln pharmazeutischer Unternehmer und Spitzenverband der gesetzlichen Krankenkassen den Arzneimittelpreis aus. Dies galt auch für Ingenolmebutat. Eine erste Bewertung durch das Institut für Qualität und Wirtschaftlichkeit im Gesundheitswesen (IQWiG) fand im April 2013 statt,[5] die Beschlussfassung durch den G-BA folgte im Juli 2013[6][7] sowie die Vereinbarung eines Erstattungsbetrages, der für die Krankenkassen in Deutschland ab 15. Januar 2014 galt. Ingenolmebutat-Gel war „das erste Präparat zur topischen Anwendung, das das Verfahren der frühen Nutzenbewertung und die sich anschließenden Erstattungsbetragsverhandlungen durchlaufen hat.“[8]
Sicherheitsaspekte
Die FDA warnte 2015 vor dem eventuellen Auftreten schwerer allergischer Reaktionen und Herpes zoster und verwies auf die Notwendigkeit der vorsichtigen und sachgemäßen Anwendung, um unerwünschte Hautreaktionen zu minimieren.[9]
Im September 2019 hat die Europäische Arzneimittel-Agentur (EMA) eine Sicherheitsprüfung von Ingenolmebutat veranlasst. Die Prüfung wurde auf Anforderung der Europäischen Kommission (EK) eingeleitet, nachdem Daten aus mehreren Studien eine erhöhte Anzahl von Hautkrebsfällen, einschließlich Fällen von Plattenepithelkarzinom, bei Patienten, die Picato anwendeten, gezeigt hatten.[10][11] Im Januar 2020 informierte der Hersteller über das Ruhen der Zulassung, das die Europäische Kommission als Vorsichtsmaßnahme angeordnet hatte, um zunächst die Überprüfung des Hautkrebsrisikos fortzusetzen.[12][13] Auf Antrag des bisherigen Zulassungsinhabers wurde dann am 11. Februar 2020 die Genehmigung des Inverkehrbringens von Picato in der Europäischen Union widerrufen.
Am 20. April 2020 beendete die Europäische Arzneimittel-Agentur die Überprüfung von Picato mit dem Ergebnis, dass die Risiken des Arzneimittels den Nutzen überwiegen. Demnach zeige Ingenolmebutat im Vergleich zu Imiquimod (ein weiterer Arzneistoff gegen aktinische Keratosen) ein erhöhtes Auftreten von Hautkrebs, insbesondere von Plattenepithelkarzinomen, in den behandelten Hautarealen. Weiterhin sei ein therapeutischer Effekt nicht dauerhaft gegeben. Außerdem stehen für aktinische Keratosen andere Behandlungsmöglichkeiten zur Verfügung.[14]
In den Vereinigten Staaten wurden keine derartigen Maßnahmen ergriffen (Stand Januar 2020).[15]
Handelsnamen
Picato (USA, EU), Ingenol Mebutate Perrigo (USA)
Einzelnachweise
- Datenblatt Ingenol-3-angelate, ≥98% (HPLC), amorphous bei Sigma-Aldrich, abgerufen am 11. August 2011 (PDF).
- Pressemitteilung: LEO Pharma announces that Picato® (ingenol mebutate) gel has been approved by US FDA for once-daily, 2 or 3 day treatment of actinic keratoses (Memento vom 22. Februar 2017 im Internet Archive), vom 26. Januar 2012, abgerufen am 21. Februar 2017.
- T. Dingermann, K. Hiller, G. Schneider, I. Zündorf: Schneider Arzneidrogen. 5. Auflage, Elsevier 2004, ISBN 3-8274-1481-4. S. 22.
- Fachinformation Picato. LEO Laboratories Ltd, Stand 15. November 2019.
- Zusatznutzen von Ingenolmebutat ist nicht belegt Pressemitteilung des IQWiG vom 15. April 2013; abgerufen am 16. April 2013.
- Nutzenbewertungsverfahren zum Wirkstoff Ingenolmebutat, 4. Juli 2013.
- Bekanntmachung eines Beschlusses des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII – Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach § 35a des Fünften Buches Sozialgesetzbuch (SGB V) – Ingenolmebutat vom: 04.07.2013 Bundesministerium für Gesundheit BAnz AT 01.08.2013 B5
- Erster Erstattungsbetrag für topisches Arzneimittel (Picato®) vereinbart. Gemeinsame Pressemitteilung vom GKV-Spitzenverband und LEO Pharma GmbH, Berlin, 15. Januar 2014.
- FDA Safety Announcement, 21. August 2015.
- Meeting highlights from the Pharmacovigilance Risk Assessment Committee (PRAC) 2-5 September 2019, EMA vom 6. September 2019 (engl.), abgerufen am 11. September 2019
- Picato (Ingenolmebutat) – Vorsicht bei der Behandlung von Patienten mit Hautkrebsanamnese. Rote-Hand-Brief, 17. September 2019, auf der BfArM-Website.
- Picato (Ingenolmebutat): Ruhen der Zulassungen als Vorsichtsmaßnahme angeordnet, die Überprüfung des Hautkrebsrisikos wird fortgesetzt, am 20. Januar 2020 auf der BfArM-Website.
- Picato (Ingenolmebutat): Ruhen der Zulassungen aufgrund des Risikos von malignen Hautveränderungen. Rote-Hand-Brief, 27. Januar 2020, auf der BfArM-Website.
- Risikobewertungsverfahren - Picato® (Ingenolmebutat): Bewertung des Nutzen-Risiko-Verhältnisses. Bundesinstitut für Arzneimittel und Medizinprodukte, 20. April 2020, abgerufen am 21. April 2020.
- European marketing of Picato suspended while skin cancer risk reviewed, the pharmaletter, 17. Januar 2020 (englisch).