Imiquimod
Imiquimod ist ein Arzneistoff aus der Gruppe der Virostatika, der zur Behandlung von kleinem, oberflächlichem Basalzell-Hautkrebs (Basaliom), aktinischer Keratose und Feigwarzen (Condylomata acuminata), sowie auch kutanen Warzen eingesetzt wird. Entwickelt wurde Imiquimod von 3M. Es wird weltweit vertrieben, in Europa von dem schwedischen Pharmaunternehmen MEDA unter dem Handelsnamen Aldara®.[3]
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
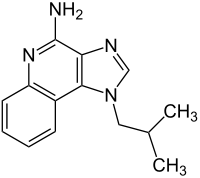 | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Freiname | Imiquimod | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C14H16N4 | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Arzneistoffangaben | |||||||||||||||||||
| ATC-Code |
D06BB10 | ||||||||||||||||||
| Wirkstoffklasse | |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 240,30 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
Als Nachfolgesubstanz von Imiquimod gilt das noch in der Entwicklung befindliche Resiquimod (R848), welches denselben Wirkmechanismus besitzt, aber wesentlich stärker wirksam ist und an zwei Toll-like Receptors (TLR) bindet.[4]
Wirkungsweise
Imiquimod ist ein Immunmodulator. Es zerstört die Viren und Krebszellen nicht, sondern es aktiviert das Immunsystem der Haut, damit es selbst gegen die Viren oder den Tumor ankämpft. Imiquimod provoziert dazu eine Entzündungsreaktion, indem es an TLR7 bindet. Dabei handelt es sich um ein Oberflächenmolekül von Zellen des Immunsystems, insbesondere von Makrophagen, welches, falls sich passende Stoffe daran anlagern, dem Immunsystem das Signal „fremd“ („nicht zum Körper gehörig“) vermittelt.[4]
Im Gegensatz zu herkömmlichen Verfahren, bei denen Warzen herausgeschnitten, eingefroren oder kauterisiert werden, beschädigt Imiquimod die Haut nicht.
Gegenanzeigen
Imiquimod soll nicht auf offene Wundflächen oder gereizte Haut aufgetragen werden. Außerdem sollte es nur nach einer intensiven Risiko-Nutzen-Abwägung in der Schwangerschaft angewandt werden. In der Stillzeit ist die Einnahme ausgeschlossen, da der Wirkstoff in die Muttermilch übergeht.
Bei Kindern und Jugendlichen unter 18 Jahren sollte der Wirkstoff nicht angewendet werden, da nicht ausreichend Forschungsergebnisse für diese Patientengruppe vorliegen.[5]
Nebenwirkungen
Imiquimod verursacht häufig Hautreizungen (Erythem, Erosion, Exkoriation/Schuppenbildung und Ödem). Bei Anwendung im Bereich der Vorhaut sind Phimosen aufgetreten. Es sind Einzelfälle schwerer systemischer Nebenwirkungen – darunter das Kapillarlecksyndrom (engl. capillary leak syndrome) – beschrieben.
Zudem treten folgende Nebenwirkungen bei der Einnahme von Imiquimod häufig auf:
- Brechreiz,
- Gelenkschmerzen,
- Harnentleerungsstörungen,
- Infektion,
- Müdigkeit,
- Muskelschmerzen,
- Reizung oder Brennen (am Auftragsort)
Bei Psoriatikern kann topisch aufgetragenes Imiquimod einen systemischen Psoriasisschub auslösen.[6]
Zulassungsstatus
Im März 2011 hat die Food and Drug Administration (FDA) Imiquimod für die USA (Zyclara®) zur Behandlung von externen und perianalen Feigwarzen zugelassen.[7] Im Juli 2011 folgte die Zulassung für aktinische Keratosen.[8]
Hinweise
Bei Anwendung im Intimbereich kann Imiquimod die Reißfestigkeit von Kondomen beeinträchtigen.
Handelsnamen
Imiquimod ist in Deutschland, Österreich und der Schweiz unter dem Namen Aldara und in den USA unter Zyclara im Handel erhältlich.
Literatur
- Journal of Cutaneous Medicine and Surgery. 2005, 9(5), S. 209–214, doi:10.1007/s10227-005-0148-6 (Systematischer Review und Meta-Analyse bei Aktinischer Keratose).
- Journal of Investigative Dermatology. 2006, 126(6), S. 1251–1255, doi:10.1038/sj.jid.5700264 (Systematischer Review und Meta-Analyse bei Aktinischer Keratose).
- Dermatology. 2006, 213(3), S. 218–223, doi:10.1159/000095039 (Systematischer Review und Meta-Analyse bei Feigwarzen).
- International Journal of Dermatology. 2006, 45, S. 1464–1465, doi:10.1111/j.1365-4632.2006.02980.x (Induktion von Psoriasis durch Imiquimod).
Einzelnachweise
- Eintrag zu Imiquimod. In: Römpp Online. Georg Thieme Verlag, abgerufen am 1. Juni 2014.
- Datenblatt Imiquimod bei Sigma-Aldrich, abgerufen am 5. April 2011 (PDF).
- Fachinformation Aldara® (PDF; 108 kB) Stand April 2010, abgerufen am 10. April 2012.
- Peter Fritsch: Dermatologie und Venerologie. 2. Auflage. Springer Verlag, 2004, ISBN 3-540-00332-0.
- Welche Kontraindikationen (Gegenanzeigen) liegen vor? Abgerufen am 25. August 2017.
- P. A. Fanti, E. Dika, S. Vaccari, C. Miscial, C. Varotti: Generalized psoriasis induced by topical treatment of actinic keratosis with imiquimod. In: International Journal of Dermatology. 45 (2006), S. 1364–1365, doi:10.1111/j.1365-4632.2006.02980.x.
- Bericht (PDF; 59 kB) der FDA an Graceway Pharmaceuticals mit dem Hinweis auf die Zulassung, 24. März 2011.
- FDA Approves Zyclara ® (imiquimod) Cream, 2.5% for the Treatment of Actinic Keratoses (Memento vom 19. September 2012 im Webarchiv archive.today), Pressemitteilung des Vertreibers vom 18. Juli 2011 (Reuters).