Hyposalpetrige Säure
Hyposalpetrige Säure ist eine Sauerstoffsäure des Stickstoff. Sie bildet farblose Kristalle, die explosiv sind. Diese sind löslich in Ethanol und Wasser.
| Strukturformel | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|
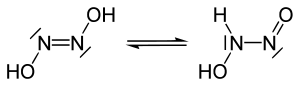 | ||||||||||
| Isomere Formen der Hyposalpetrigen Säure | ||||||||||
| Allgemeines | ||||||||||
| Name | Hyposalpetrige Säure | |||||||||
| Andere Namen |
| |||||||||
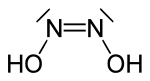
| Summenformel | H2N2O2 | |||||||||
| Kurzbeschreibung |
farblose, im trockenen Zustand explosive Plättchen[1] | |||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||
| ||||||||||
| Eigenschaften | ||||||||||
| Molare Masse | 62,0 g·mol−1 | |||||||||
| Aggregatzustand |
fest | |||||||||
| pKS-Wert | ||||||||||
| Löslichkeit | ||||||||||
| Sicherheitshinweise | ||||||||||
| ||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||
Ihre Salze heißen Hyponitrite, z. B.: Kaliumhyponitrit (K2N2O2).
Herstellung
trans-Hyposalpetrige Säure kann durch Reduktion von Salpetriger Säure oder Natriumnitrit mit nascierendem Wasserstoff (z. B. aus Natrium-Amalgam) hergestellt werden.[2][4]
Das wasserlösliche Natriumsalz kann mit Silbernitrat als gelbes, unlösliches Silberhyponitrit abgetrennt werden:
Nach dem Abtrennen kann die trans-Hyposalpetrige Säure mit HCl-Gas in Ether wieder gelöst werden:
Eigenschaften
trans-Hyposalpetrige Säure ist ein farbloser Feststoff, der in Form von zerfließlichen Kristallblättchen vorliegt und eine sehr schwache Säure darstellt. Er ist sehr explosiv, verpufft schon beim Reiben mit einem Glasstab und zersetzt sich spontan auch ohne erkennbaren Anlass und auch bei Kühlung auf −6 °C. Er ist sehr leicht löslich in Wasser und in Ethanol, leicht auch in Ether, Benzol und Trichlormethan, jedoch schwer in Ligroin.[4]
Isomerie
Es existieren eine cis- und eine stabilere trans-Hyposalpetrige Säure.
Von der cis-Form sind nur die Salze bekannt; die trans-Form lässt sich in Substanz isolieren.[2]
Reaktionen
Mit Alkalimetallen bildet die Hyposalpetrige Säure Salze, die Hyponitrite:
Die schwach saure wässrige Lösung der Säure zerfällt bereits bei Zimmertemperatur zu Distickstoffmonoxid und Wasser:
Die Reaktion ist nicht umkehrbar[5]; Distickstoffmonoxid ist also nur formal Anhydrid der hyposalpetrigen Säure.[2]
Sie eignet sich auch als Reaktionspartner für Hetero-Diels-Alder-Reaktionen.
Einzelnachweise
- Eintrag zu Hyposalpetrigsäure. In: Römpp Online. Georg Thieme Verlag, abgerufen am 10. November 2014.
- A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 101. Auflage. Walter de Gruyter, Berlin 1995, ISBN 3-11-012641-9.
- Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- G. Brauer (Hrsg.), Handbook of Preparative Inorganic Chemistry 2nd ed., vol. 1, Academic Press 1963, S. 492–6.
- E. Riedel, C. Janiak: Anorganische Chemie. 8. Auflage. de Gruyter, 2011, ISBN 3-11-022566-2, S. 488.