Herzklappenersatz
Als Herzklappenersatz oder künstliche Herzklappe bezeichnet man einen künstlich eingebrachten Ersatz für eine natürliche Herzklappe. Man unterscheidet dabei nach der Position (Aortenklappe, Mitralklappe, Pulmonalklappe oder Trikuspidalklappe), nach der Art (mechanische und biologische Herzklappen) sowie nach dem Implantationsverfahren (offen-chirurgisch oder minimalinvasiv) des Klappenersatzes.
Abhängig von der Indikation ist die Herzklappenrekonstruktion das alternative Verfahren.
Geschichte


2. Starr-Edwards-Herzklappe
3. Smeloff-Cutter-Herzklappe
Am 11. September 1952 setzte Charles A. Hufnagel von der Georgetown University eine von ihm entwickelte Herzklappe in die absteigende Aorta (Aorta descendens) einer Patientin mit Aortenklappeninsuffizienz ein. Die künstliche Klappe lag also deutlich entfernt von der natürlichen Aortenklappe, die sich an der Aortenbasis befindet, verbesserte aber trotzdem den Blutfluss (Hämodynamik). Die Technik war zuvor an Hunden erprobt worden.[1][2][3][4]
Die erste künstliche Herzklappe in Form einer Kugelprothese wurde 1961 durch die beiden Amerikaner Albert Starr und Lowell Edwards implantiert.
Im Jahr 2010 wurden in Deutschland 30.492 Herzklappenersatzoperationen durchgeführt. Den größten Anteil daran machte mit 26.208 (86,0 %) der Aortenklappenersatz aus. Bei Mitralklappenvitien war häufig eine Rekonstruktion möglich (7.728 Eingriffe), ein Mitralklappenersatz wurde 4.146 Mal (13,6 %) durchgeführt. Der Trikuspidalklappenersatz spielte mit 138 Eingriffen (0,4 %) nur eine untergeordnete Rolle.[5]
Indikation
Die Indikation zur Operation wird in Abhängigkeit von klinischer Symptomatik und objektivierbaren Kriterien gestellt.[6] Ziel ist neben der Symptomerleichterung vor allem die Verhinderung einer akuten oder chronischen Herzinsuffizienz. Das Schlagvolumen und damit das Herzzeitvolumen sollen vergrößert werden. Die folgende Aufstellung gibt einen vereinfachten Überblick zu den häufigsten Operationen. Nicht erwähnt werden hier die Trikuspidalklappenstenose, die Trikuspidalklappeninsuffizienz, die Pulmonalklappenstenose, die Pulmonalklappeninsuffizienz und die kombinierten Vitien.
Aortenklappenstenose
- schwere Aortenklappenstenose und Symptomatik
- schwere Aortenklappenstenose ohne Symptomatik mit reduzierter Pumpfunktion (EF < 50 %) oder pathologischem Belastungstest oder rascher Progredienz
Aortenklappeninsuffizienz
- schwere Aortenklappeninsuffizienz und Symptomatik
- schwere Aortenklappeninsuffizienz ohne Symptomatik mit reduzierter Pumpfunktion (EF < 50 %) oder endsystolischem Durchmesser des linken Ventrikels > 50 mm
Mitralklappenstenose
- erhebliche Symptomatik und Klappenöffnungsfläche < 1,5 cm² und Valvuloplastie nicht möglich
- geringe Symptomatik und Klappenöffnungsfläche < 1,0 cm² und Valvuloplastie nicht möglich
Mitralklappeninsuffizienz
- schwere Mitralklappeninsuffizienz und Symptomatik und EF > 30 %
- schwere Mitralklappeninsuffizienz ohne Symptomatik mit EF < 60 % oder neu aufgetretenem Vorhofflimmern oder systolischem pulmonal-arteriellem Druck > 50 mmHg
Offen-chirurgische Technik
Nach Indikationsstellung zum offen-chirurgischen Aortenklappenersatz werden Untersuchungen zur Abschätzung des Operations- und Narkoserisikos durchgeführt. Diese umfassen z. B. eine Lungenfunktionsprüfung und eine Herzkatheteruntersuchung. Wird bei letzterer eine koronare Herzkrankheit festgestellt, wird in der Regel die Anlage von Koronararterienbypässen empfohlen, die in einer Sitzung mit dem Klappenersatz erfolgen kann.
Operationsablauf

Die Operation erfolgt in Vollnarkose unter Verwendung der Herz-Lungen-Maschine. Der Brustkorb wird durch Aufsägen des Brustbeins eröffnet (mediane Sternotomie). Nach Eröffnung des Herzbeutels und Freilegung des Herzens wird die Herz-Lungen-Maschine angeschlossen. Sie ermöglicht die Blutversorgung des Körpers unter Ausschaltung des Herzens durch Abklemmen der großen Gefäße. Mittels kardiopleger Lösung wird das Herz dazu zum Stillstand gebracht. Nun wird die betroffene Herzklappe freigelegt. Beim Aortenklappenersatz geschieht dies über die Aorta, der Zugang zur Mitralklappe erfolgt über den linken Vorhof. Die betroffene Herzklappe wird, falls nötig, zunächst entkalkt und anschließend entfernt. Dazu werden die Klappensegel aus dem Klappenring ausgeschnitten. Ziel ist es, Platz für eine möglichst große Klappenprothese zu schaffen. Zur Fixierung der Prothese werden Haltefäden mit Filzbewehrung vorgelegt. Über diese wird die künstliche Herzklappe in die richtige Position geführt und fixiert. Beim Aortenklappenersatz unterscheidet sich die Art der Fixierung in Abhängigkeit von der verwendeten Prothese. Biologische Klappen ohne mechanisches Gerüst werden entweder unter Erhalt der eigenen Koronargefäße (subkoronare Technik) oder, bei Verwendung eines größeren Aortensegments, mit Reimplantation der Koronargefäße eingesetzt. Anschließend erfolgt der Verschluss der Aorta beziehungsweise des linken Vorhofs und die Entfernung der Herz-Lungen-Maschine. Anschließend erfolgt bei wieder schlagendem Herzen der Verschluss von Herzbeutel und Brustkorb.[7]
Auswahl der Klappenprothese
Grundsätzlich werden zwei Arten von Herzklappenprothesen unterschieden: Mechanische Klappen werden künstlich hergestellt und bestehen zum größten Teil aus Metall, biologische Klappen (Gewebeklappen) stehen als Transplantate von Mensch oder Tier zur Verfügung.
Mechanische und biologische Klappenprothesen unterscheiden sich in einigen Punkten, anhand derer die Auswahl der für den Patienten am besten geeigneten Klappe erfolgt. Mechanische Herzklappen haben eine wesentlich höhere Lebensdauer als biologische Klappenprothesen. In Labortests haben mechanische Herzklappen eine (theoretische) Haltbarkeit von 100 bis 300 Jahren erreicht. Diese Angabe bezieht sich auf die Anzahl der Öffnungs- und Schließvorgänge gerechnet auf die normale Herzfrequenz von 60 bis 80 Schlägen pro Minute. Die Lebensdauer biologischer Herzklappen ist begrenzt, da sie im Vergleich zum eigenen Gewebe einem beschleunigten Alterungsprozess (Verkalkung) unterliegen. Dieser kann nach einigen Jahren zu sichtbaren und auch funktionell bedeutsamen Funktionsstörungen führen, die einen Austausch notwendig machen. Erfahrungsgemäß verkalken biologische Herzklappen bei Kindern früher und schneller als bei Erwachsenen.[8] Ein wesentlicher Nachteil der mechanischen Klappen besteht in der gerinnungsaktivierenden Metalloberfläche. Dies führt zu einem erhöhten Risiko von Thrombosen und Thrombembolien und macht eine lebenslange Antikoagulation notwendig.
Grundsätzlich werden mechanische Klappen damit bei Patienten eingesetzt, die eine hohe Lebenserwartung haben und bei denen keine Kontraindikation für eine Antikoagulation vorliegt. Die Entscheidung, welche Art von Klappenprothese verwendet wird, beruht jedoch immer auf individueller Abwägung aller Vor- und Nachteile für den einzelnen Patienten.
Mechanische Herzklappen

Mechanische Herzklappen gibt es in verschiedenen Bauformen und Größen, die alle bauartbedingte Vor- und Nachteile haben. Man unterscheidet Kugel-, Scheiben- und Doppelflügelklappen.[9] Grundsätzlich bestehen mechanische Klappen aus einem metallenen Korpus und einem Gerüst, das mit einer Polyestermanschette versehen ist. Alle mechanischen Bauformen verursachen ein mehr oder weniger stark hörbares Klappengeräusch („Prothesenklick“). Dieses Geräusch entsteht beim Schließen der Klappe, wenn der oder die Klappenflügel auf den Klappenring aufprallen. Die Klarheit dieses Geräusches ist ein Indiz dafür, ob sich Ablagerungen auf der Klappe gebildet haben. Alle mechanischen Klappen erzeugen in der Sonographie eine starke Reflexion und einen Schallschatten.
Bauformen (Auswahl)
- Kippscheibenklappen (mit Kippscheibenventilen)
- St. Jude Medical: zweiflüglige Klappe (seit 1977)
- Björk-Shiley-Prothese: einflüglige Klappe (aufgehängter Diskus, seit 1968)
- Lillehei-Kaster-Prothese: benannt nach Clarence Walton Lillehei
- Medtronic Hall: einflüglige Klappe (Diskus mit zentralem Loch). Der Diskus bewegt sich auf einem gebogenen Dorn innerhalb des Klappenrings. Der Klappenring ist ein gefräster Titan-Monoblock.
- Kugelklappe, Käfigklappe
- Starr-Edwards-Kugelklappe (die älteste Käfigklappe): Kugelkäfigprothese (erster Einsatz 1952). Als Ventil bzw. Verschlusskörper dient eine Kunststoffkugel, die sich in einem Drahtkäfig mit der Blutströmung frei hin- und herbewegt. Dies war der erste künstliche Klappentyp und ist jetzt (fast) ohne Bedeutung, da bei dieser Variante durch das bauartbedingte Gewicht entscheidende Nachteile entstehen (Hämolyse).
- Smeloff-Cutter-Kugelklappe
Biologische Herzklappen
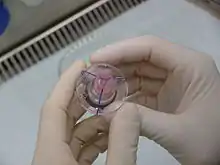
Bei biologischen Klappen, die im Prinzip die Segelbewegungen normaler Herzklappen ausführen, besteht das Klappengewebe aus menschlichem (Allo- oder Homograft) oder tierischem (Xenograft) Gewebe. Beim so genannten Tissue Engineering werden Gerüststrukturen mit patienteneigenen Zellen im Bioreaktor besiedelt. Diese künstlich besiedelten Klappen spielen im klinischen Alltag noch keine bedeutende Rolle, gehören aber etwa an der Medizinischen Hochschule Hannover zum regelmäßig praktizierten klinischen Alltag.[10] Das eigentliche Klappengewebe wird in einem Gittertubus („Stent“) oder auf einer Gerüststruktur („Scaffold“) angesiedelt bzw. gerüstfrei verwendet. Ebenso wie künstliche Herzklappen sind auch biologische Klappen zum Einnähen mit einer Polyestermanschette umgeben. Tierische- und menschliche Spenderklappen müssen nach der Entnahme für die spätere Implantierung konserviert werden. Hierbei hat sich die Kryokonservierung in flüssigem Stickstoff als effektivstes Verfahren durchgesetzt. Alternativen sind die Präparation in einer antibiotischen Lösung bei 4 °C, Röntgenbestrahlung und Trockengefrierung. Bei Dezellularisierten Homografts werden durch Waschverfahren zuvor die Zellen des Spenders aus der Herzklappe entfernt.
Gewebeklappen haben entweder ein Stentimplantat (Gerüst) oder sie sind stentlos. Gestentete Klappen sind in Größen von 19 mm bis 29 mm erhältlich[11]. Stentlose Klappen werden direkt an die Aortenwurzel genäht. Der Hauptvorteil von stentlosen Klappen besteht darin, dass sie die Fehlanpassung zwischen dem Patient und der Prothese begrenzen (wenn die Oberfläche der Klappenprothese im Verhältnis zur Größe des Patienten zu klein ist wird dadurch der Druck innerhalb der Klappe erhöht[12]), so dass sie bei kleinen Aortenwurzeln hilfreich sein können. Ihr Nachteil ist, dass das Implantieren von stentlosen Klappen zeitaufwändiger ist als von gestenteten Klappen[11]
Gewebeklappen können 10–20 Jahre halten.[13] Tendenziell verschlechtern sie sich jedoch bei jüngeren Patienten schneller.[14] Es wurden neue Möglichkeiten untersucht, um Gewebe länger zu erhalten. Eine solche Konservierungsbehandlung wird jetzt bei einer kommerziell erhältlichen Gewebeherzklappe eingesetzt. In Schaf- und Kaninchenstudien wies das Gewebe (RESILIA™ Gewebe genannt) weniger Verkalkung auf als das Kontrollgewebe.[15][16] Daten zur Langzeithaltbarkeit bei Patienten liegen jedoch noch nicht vor.[17]
Schon länger bestehende Typen von Bioprothesen sind beispielsweise die Hancock-Bioprothese, der Hancock-Conduit und die Ionescu-Shiley-Bioprothese[18] sowie die biologischen Carpentier-Edwards-Klappen.
Ozaki-Prozedur
Das relativ neue Ozaki-Verfahren, benannt nach dem japanischen Arzt Shigeyuki Ozaki, kann in der Aortenposition angewendet werden. Dabei werden die Klappensegel im Verlauf der Operation etwa aus Herzbeutelgewebe nachgebaut und in den patienteneigenen Aortenklappenring eingefügt.[19] Von Wissenschaftlern des Universitätsklinikums Schleswig-Holstein, Campus Lübeck, wurde 2020 begonnen, das Verfahren genauer zu untersuchen.[20]
Ross-Operation
Eine Sonderform stellt die Ross-Operation dar. Dieses Verfahren wird vor allem bei Kindern und jungen Erwachsenen eingesetzt. Bei Vorliegen eines Aortenvitiums wird die Aortenklappe entfernt und durch die patienteneigene Pulmonalklappe ersetzt. Die Pulmonalklappe kann aufgrund der niedrigeren Druckbelastung dann durch eine biologische Klappe ersetzt werden.
Minimalinvasive Verfahren
Transkatheter-Aortenklappenimplantation (TAVI)
Neben der offen-chirurgischen Technik existiert ein kathetergestütztes Verfahren, bei dem ein Zugangsweg über die Leistenarterie (transfemoral) oder über die Herzspitze (transapikal) gewählt wird. Dieses Verfahren wird Transkatheter-Aortenklappenimplantation (engl. transcatheter aortic valve implantation, TAVI) oder Endovaskulärer Aortenklappenersatz genannt. Die Aortenklappe ist dabei in einem Metallgerüst eingebracht. Mittels Katheter wird die Klappe in Position gebracht. Anschließend wird sie entfaltet und dadurch im Klappenring verankert. Die körpereigene Aortenklappe wird dabei nicht entfernt, sondern durch die Prothese verdrängt. Es werden selbstexpandierende Klappen von solchen unterschieden, die – etwa vergleichbar mit einer PTCA – mittels Ballon expandiert werden.
Die Technik wurde erstmals von Alain Cribier und Kollegen im Jahr 2002 beschrieben.[21] Ziel der TAVI ist es, einen Aortenklappenersatz den Patienten anbieten zu können, deren Operationsrisiko für einen offen-chirurgischen Ersatz zu hoch eingeschätzt wird; nach und nach wird die Indikation auch auf Patienten mit mittlerem Operationsrisiko zu Studienzwecken ausgeweitet.[22] Die minimalinvasive Form der Therapie ist jedoch bisher kein genereller Ersatz für die offen-chirurgische Technik. Langzeitergebnisse für die Transkatheter-Aortenklappenimplantation liegen aufgrund der Neuheit des Verfahrens noch nicht vor, allerdings deuten erste Ergebnisse aus 5-Jahres-Analysen darauf hin, dass die Hämodynamik und die Stabilität der TAVI-Klappen gleichwertig mit chirurgisch implantierten Aortenklappen zu sein scheint.[23] Die Deutsche Gesellschaft für Kardiologie hat 2014 Qualitätsstandards zur Durchführung der TAVI veröffentlicht – zu den wichtigsten Forderungen gehören, dass der Eingriff in einem Hybrid-Operationssaal stattfinden sollte und ein Herzchirurg bereitsteht.[24]
Die Anwendung der TAVI kann mit folgenden Risiken einhergehen[25]
- erhöhtes Schlaganfallrisiko (siehe auch Zerebrale Embolieprotektion beim Tavi)
- Komplikationen bei Einbringung der Prothese durch die Gefäße, wie Gefäßverletzungen
- Notwendigkeit eines erneuten Eingriffs, z. B. durch Undichtigkeiten zwischen Prothese und Gefäßwand
- kompletter atrioventrikulärer Block mit Notwendigkeit einer Schrittmacherimplantation
Bedeutende Hersteller sind:
- Edwards Lifesciences mit Sapien (ballonexpandierend) und
- Medtronic mit CoreValve (selbstexpandierend)
Nachsorge
Postoperative Phase
Nach der Operation wird der Patient zunächst auf der Intensivstation überwacht. Hier wird die künstliche Beatmung beendet. Im weiteren Verlauf wird der Patient auf einer kardiochirurgischen oder kardiologischen Normalstation betreut. An den ein- bis zweiwöchigen Aufenthalt im Akutkrankenhaus schließt sich in der Regel eine mehrwöchige Rehabilitation mit kontrolliert ansteigender körperlicher Belastung an. Eine Wiederaufnahme der Berufstätigkeit ist etwa zehn bis zwölf Wochen nach der Operation möglich.
Verlaufskontrollen
Zur Beurteilung des postoperativen Verlaufs spielt die Echokardiographie eine entscheidende Rolle, da hier die Klappenfunktion (Dichtigkeit, Druckgradienten) und, vor allem bei biologischen Klappen, die Klappenmorphologie beurteilt werden können. Die erste Verlaufskontrolle sollte nach etwa drei Monaten erfolgen.[6]
Antikoagulation
Bei Verwendung eines mechanischen Herzklappenersatzes muss eine lebenslange Antikoagulation erfolgen. Dazu werden Cumarinderivate wie Phenprocoumon und Warfarin eingesetzt. Die angestrebte INR richtet sich nach der Position der Prothese.[6] Nach biologischem Klappenersatz ist eine Antikoagulation für drei Monate notwendig. Nach TAVI wird die Einnahme von Thrombozytenaggregationshemmern empfohlen; die alleinige Gabe von Acetylsalicylsäure war in einer Untersuchung der Gabe einer Kombinationstherapie mit Clopidogrel bei TAVI-Patienten überlegen.[26]
Endokarditisprophylaxe
Nach Herzklappenersatz ist eine lebenslange Endokarditisprophylaxe bei allen Eingriffen im Bereich des Mund-Rachen-Raums (z. B. Zahnchirurgie, Tonsillektomie) empfohlen.[6]
Siehe auch
Literatur
- Martin Steiner: Beurteilung von biologischen und mechanischen Herzklappenprothesen anhand zeitaufgelöster Verfahren (Dissertation). VVB Laufersweiler Verlag, Gießen 2005, ISBN 3-89687-053-X, S. 319.
- Michael J. Eichler: In vitro Kavitationsuntersuchungen an mechanischen Herzklappenprothesen (Dissertation). Logos Verlag, Berlin 2003, ISBN 3-8325-0398-6, S. 175.
- Klaus Holldack, Klaus Gahl: Auskultation und Perkussion. Inspektion und Palpation. Thieme, Stuttgart 1955; 10., neubearbeitete Auflage ebenda 1986, ISBN 3-13-352410-0, S. 180 f. (Töne und Geräusche an künstlichen Herzklappen).
Einzelnachweise
- Vinzenz Hombach (Herausgeber): "Interventionelle Kardiologie, Angiologie und Kardiovaskularchirurgie", Schattauer Verlag 2001, S. 257.
- L. Wi Stephenson: History of Cardiac Surgery. (Memento vom 1. Juli 2007 im Internet Archive) In: L. H. Cohn, L. H. Edmunds Jr. (Hrsg.): Cardiac Surgery in the Adult. McGraw-Hill, New York (USA) 2003, S. 3–29.
- C. A. Hufnagel, M. N. Gomes: Late follow-up of ball-valve prostheses in the descending thoracic aorta. In: J Thorac Cardiovasc Surg. Band 72, Nr. 6, 1976, S. 900–909.
- Glenn Fowler: Obituaries: Charles A. Hufnagel, 72, Surgeon Who Invented Plastic Heart Valve. In: New York Times. 1. Juni 1989, abgerufen am 11. Juli 2020 (englisch).
- J. F. Gummert, A. K. Funkat, A. Beckmann, M. Ernst, K. Hekmat, F. Beyersdorf, W. Schiller: Cardiac surgery in Germany during 2010: a report on behalf of the German Society for Thoracic and Cardiovascular Surgery. In: Thorac Cardiovasc Surg. 2011 Aug;59(5), S. 259–267.
- Hans Joachim Geißler, Christian Schlensak, Michael Südkamp, Friedhelm Beyersdorf: Herzklappenchirurgie heute: Indikationsstellung, OP-Technik und ausgewählte Aspekte der Nachsorge bei erworbenen Herzklappenvitien. In: Dtsch Arztebl Int. 2009; 106(13), S. 224–233.
- G. Ziemer, A. Haverich: Herzchirurgie. 3. Auflage. Springer Verlag, 2010, S. 614 ff. und S. 641 ff.
- Dietmar Boethig, Wolf-Rüdiger Thies, Hartmut Hecker, Thomas Breymann: Mid term course after pediatric right ventricular outflow tract reconstruction: a comparison of homografts, porcine xenografts and Contegras. In: European Journal of Cardio-Thoracic Surgery. Band 27, Nr. 1. Elsevier, 2005, S. 58–66, doi:10.1016/j.ejcts.2004.09.009.
- Reinhard Larsen: Anästhesie und Intensivmedizin in Herz-, Thorax- und Gefäßchirurgie. (1. Auflage 1986) 5. Auflage. Springer, Berlin/ Heidelberg/New York u. a. 1999, ISBN 3-540-65024-5, S. 221 f.
- Deutscher Ärzteverlag GmbH, Redaktion Deutsches Ärzteblatt (Hrsg.): Aortenklappenersatz: Therapieoption für junge Patienten. (online [abgerufen am 13. August 2017]).
- Sabiston: Sabiston and Spencer's Surgery of the Chest E-Book. Hrsg.: Elsevier Health Sciences. 2010, ISBN 978-1-4557-0009-7 (Google Buch).
- Philippe Pibarot, Jean G. Dumesnil: Prosthetic Heart Valves: Selection of the Optimal Prosthesis and Long-Term Management. In: Circulation. Band 119, Nr. 7, 24. Februar 2009, ISSN 0009-7322, S. 1034–1048, doi:10.1161/CIRCULATIONAHA.108.778886, PMID 19237674.
- Christopher Harris, Beth Croce, Christopher Cao: Tissue and mechanical heart valves. In: Annals of Cardiothoracic Surgery. Band 4, Nr. 4, 7. Oktober 2015, ISSN 2225-319X, S. 399, doi:10.3978/6884, PMID 26309855, PMC 4526499 (freier Volltext) – (Online).
- Douglas R. Johnston, Edward G. Soltesz, Nakul Vakil, Jeevanantham Rajeswaran, Eric E. Roselli, Joseph F. Sabik, Nicholas G. Smedira, Lars G. Svensson, Bruce W. Lytle: Long-Term Durability of Bioprosthetic Aortic Valves: Implications From 12,569 Implants. In: The Annals of Thoracic Surgery. Band 99, Nr. 4, 2015, S. 1239–1247, doi:10.1016/j.athoracsur.2014.10.070, PMID 25662439, PMC 5132179 (freier Volltext).
- Willem Flameng, Hadewich Hermans, Erik Verbeken, Bart Meuris: A randomized assessment of an advanced tissue preservation technology in the juvenile sheep model. In: The Journal of Thoracic and Cardiovascular Surgery. Band 149, Nr. 1, 2015, ISSN 0022-5223, S. 340–345, doi:10.1016/j.jtcvs.2014.09.062, PMID 25439467.
- Hao Shang, Steven M. Claessens, Bin Tian, Gregory A. Wright: Aldehyde reduction in a novel pericardial tissue reduces calcification using rabbit intramuscular model. In: Journal of Materials Science: Materials in Medicine. Band 28, Nr. 1, 20. Dezember 2016, ISSN 0957-4530, S. 16, doi:10.1007/s10856-016-5829-8, PMID 28000112, PMC 5174141 (freier Volltext).
- Krzysztof Bartuśm, Radosław Litwinowicz, Mariusz Kuśmierczyk, Agata Bilewska, Maciej Bochenek, Maciej Stąpór, Sebastian Woźniak, Jacek Różański, Jerzy Sadowski: Primary safety and effectiveness feasibility study after surgical aortic valve replacement with a new generation bioprosthesis: one-year outcomes. In: Kardiologia Polska. Band 76, Nr. 3, 19. Dezember 2017, ISSN 0022-9032, S. 618–624, doi:10.5603/KP.a2017.0262, PMID 29297188 (online).
- Reinhard Larsen: Anästhesie und Intensivmedizin in Herz-, Thorax- und Gefäßchirurgie. 1999, S. 222 f.
- Lübecker Herzchirurgen konstruieren Herzklappe aus Patientengewebe - erstmals in Norddeutschland. 6. Juli 2018, abgerufen am 6. April 2019.
- Forschungspreis für Dr. Buntaro Fujita: Universität zu Lübeck. Abgerufen am 9. September 2020.
- A. Cribier, H. Eltchaninoff, A. Bash, N. Borenstein, C. Tron, F. Bauer, G. Derumeaux, F. Anselme, F. Laborde, M. B. Leon: Percutaneous transcatheter implantation of an aortic valve prosthesis for calcific aortic stenosis: first human case description. In: Circulation. 2002;106(24), S. 3006–3008.
- Michael J. Reardon, Nicolas M. Van Mieghem, Jeffrey J. Popma, Neal S. Kleiman, Lars Søndergaard: Surgical or Transcatheter Aortic-Valve Replacement in Intermediate-Risk Patients. In: New England Journal of Medicine. Band 376, Nr. 14, 6. April 2017, ISSN 0028-4793, S. 1321–1331, doi:10.1056/NEJMoa1700456, PMID 28304219.
- Melissa A. Daubert, Neil J. Weissman, Rebecca T. Hahn, Philippe Pibarot, Rupa Parvataneni: Long-Term Valve Performance of TAVR and SAVR. In: JACC: Cardiovascular Imaging. Band 10, Nr. 1, 1. Januar 2017, S. 15–25, doi:10.1016/j.jcmg.2016.11.004 (sciencedirect.com [abgerufen am 13. August 2017]).
- Kuck et al. Positionspapier der Deutschen Gesellschaft für Kardiologie – Qualitätskriterien zur Durchführung der transvaskulären Aortenklappenimplantation (TAVI), 2016.
- Faktenblatt Aortenklappenersatz GKV-Spitzenverband PDF-Dokument, abgerufen am 6. Januar 2016 (Memento vom 7. März 2016 im Internet Archive)
- Jorn Brouwer, Vincent J. Nijenhuis, Ronak Delewi, Renicus S. Hermanides, Wouter Holvoet: Aspirin with or without Clopidogrel after Transcatheter Aortic-Valve Implantation. In: New England Journal of Medicine. 30. August 2020, doi:10.1056/NEJMoa2017815 (nejm.org [abgerufen am 7. September 2020]).
Weblinks
- Herzklappe mit einem Klappenflügel
- Bioreaktoren für nachgezüchtete Herzklappen
- Möglichkeiten und Grenzen des minimalinvasiven Herzklappenersatzes
- S2k-Leitlinie Zahnsanierung vor Herzklappenersatz der Deutschen Gesellschaft für Mund-, Kiefer- und Gesichtschirurgie (DGMKG) und der Deutschen Gesellschaft für Zahn-, Mund- und Kieferheilkunde (DGZMK). In: AWMF online (Stand April 2017)