Hafnocendichlorid
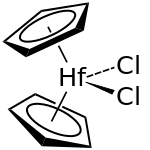
Hafnocendichlorid oder nach IUPAC-Nomenklatur Dichlorobis(η5-cyclopentadienyl)hafnium(IV), ist eine metallorganische Verbindung aus der Familie der Metallocene. Wie das analoge Titanocendichlorid ist auch Hafnocendichlorid ein 16-Elektronen-Komplex. Der reaktive farblose Feststoff zersetzt sich rasch in Wasser.[4]
| Strukturformel | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||
| Allgemeines | |||||||||||||
| Name | Hafnocendichlorid | ||||||||||||
| Andere Namen |
| ||||||||||||
| Summenformel | C10H10Cl2Hf | ||||||||||||
| Kurzbeschreibung |
farblose Kristalle[1] | ||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||
| |||||||||||||
| Eigenschaften | |||||||||||||
| Molare Masse | 379,59 g·mol−1 | ||||||||||||
| Aggregatzustand |
fest[2] | ||||||||||||
| Dichte |
12,7 g·cm−3[3] | ||||||||||||
| Schmelzpunkt |
230–233 °C[2] | ||||||||||||
| Löslichkeit |
löslich in aromatischen Lösemitteln und Chloroform, schwach löslich in THF und Diethylether, unlöslich in n-Hexan.[1] Zersetzung in Wasser[4] | ||||||||||||
| Sicherheitshinweise | |||||||||||||
| |||||||||||||
| Toxikologische Daten | |||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||
Gewinnung und Darstellung
Über die Darstellung von Hafnocenedichlorid durch Umsetzung von Hafniumtetrachlorid mit Cyclopentadienylnatrium in einer Mischung von Toluol und DME wurde 1969 von Druce, Kingston, Lappert, Spalding und Srivastava berichtet.[5][6]
Eigenschaften
Physikalische Eigenschaften
Im Gegensatz zu den Metallocenen sind im Hafnocendichlorid die Cyclopentadienylringe nicht koplanar angeordnet, sondern sind im Molekül mit den beiden Chlorid-Liganden verzerrt tetraedrisch um das zentrale Hafniumatom angeordnet.
Verwendung
Hafnocendichlorid findet in Polymerisationskatalysatoren Verwendung, welche 1980 von Hansjörg Sinn und Walter Kaminsky beschrieben wurden. Diese sogenannten Kaminsky-Katalysatoren, die aus Mischungen der Metallocendihalogenide (Typ 1) mit Methylaluminoxan (MAO) bestehen, erlauben die Polymerisation von Ethylen, Propylen oder Olefin-Mischungen mit sehr hoher Produktivität.[7]
Einzelnachweise
- Takeo Taguchi, Yuji Hanzawa, Keisuke Suzuki, Yasuhito Koyama: Dichlorobis(cyclopentadienyl)hafnium. In: e-EROS Encyclopedia of Reagents for Organic Synthesis. Band 28, 1990, S. 267–270, doi:10.1002/047084289X.rd089s.pub2.
- Datenblatt Bis(cyclopentadienyl)hafnium(IV) dichloride bei Sigma-Aldrich, abgerufen am 22. Juli 2014 (PDF).
- Guidechem: Hafnium, dichlorobis(h5-2,4-cyclopentadien-1-yl)-(CAS No. 12116-66-4), aufgerufen am 11. März 2015.
- Datenblatt Bis(cyclopentadienyl)hafnium dichloride (PDF) bei Strem, abgerufen am 11. März 2015.
- P. M. Druce, B. M. Kingston, M. F. Lappert, T. R. Spalding, R. C. Srivastava: Metallocene halides. Part I. Synthesis, spectra, and redistribution equilibria of di-n-cyclopentadienyldihalogeno-titanium(IV),-zirconium(IV), and -hafnium(IV). In: Journal of the Chemical Society A: Inorganic, Physical, Theoretical. 1969, S. 2106, doi:10.1039/J19690002106.
- Wolfgang A. Herrmann: Synthetic Methods of Organometallic and Inorganic Chemistry, Volume 8, 1997. Georg Thieme Verlag, 2014, ISBN 978-3-131-79481-9, S. 32 (eingeschränkte Vorschau in der Google-Buchsuche).
- Hansjörg Sinn, Walter Kaminsky, Hans-Jürgen Vollmer, Rüdiger Woldt: „Lebende Polymere“ bei Ziegler-Katalysatoren extremer Produktivität. In: Angewandte Chemie. Band 92, Nr. 5, 1980, S. 396–402, doi:10.1002/ange.19800920517.
