Glinide
Glinide sind Arzneistoffe aus der Gruppe der oralen Antidiabetika, die beim Diabetes mellitus Typ 2 eingesetzt werden können. In ihrem strukturellen Aufbau und ihrem Wirkungsmechanismus sind sie eng mit den Sulfonylharnstoffen verwandt, stimulieren wie diese die körpereigene Insulinsekretion und werden daher teilweise auch als Sulfonylharnstoff-Analoga bezeichnet.[1] Die derzeit verfügbaren Vertreter der Gruppe sind Nateglinid und Repaglinid. In Deutschland dürfen mit Wirkung ab 1. Juli 2016 Glinide zulasten der gesetzlichen Krankenversicherung nur noch in medizinisch begründeten Einzelfällen bei Patienten mit Einschränkung der Nierenfunktion verordnet werden.[2]
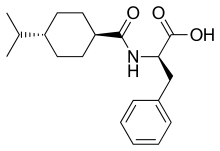
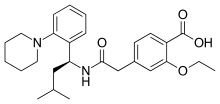
Pharmakologische Eigenschaften
Pharmakodynamik
Glinide wirken ebenso wie die Sulfonylharnstoffe durch eine Blockade ATP-sensitiver Kaliumkanäle an den β-Zellen der Bauchspeicheldrüse. Durch diese Blockade bricht das Membranruhepotential, welches im Wesentlichen durch die Diffusion von Kaliumionen aufrechterhalten wird, zusammen, es kommt zur Membrandepolarisation. Dies führt zur Öffnung spannungsabhängiger Calciumkanäle und Calciumionen strömen ins Zellinnere. Insulin-haltige Vesikel verschmelzen verstärkt mit der Zellmembran (Exozytose), es kommt zu einer verstärkten Insulinfreisetzung. Aufgrund dieses Wirkmechanismus zählen die Glinide zu den insulinotropen Antidiabetika.[1]
Pharmakokinetik
Unterschiede zu den Sulfonylharnstoffen finden sich bei den pharmakokinetischen Eigenschaften der Glinide. Besonders hervorzuheben sind hier die schnelle Resorption und die kurze Halbwertszeit. So werden mit Nateglinid und Repaglinid maximale Plasmakonzentrationen innerhalb von etwa einer Stunde erreicht, bei den häufig verwendeten Sulfonylharnstoffen Glibenclamid und Glimepirid nach etwa zwei bis drei Stunden. Die kurze Zeit des Anflutens ist auch der Grund, weshalb die Einnahme der Glinide kurz vor den Hauptmahlzeiten erfolgen soll. Die Bioverfügbarkeit der Glinide ist mit 60 bis 75 % etwas geringer als bei den Sulfonylharnstoffen mit 90 bis 100 %. Die Verstoffwechselung erfolgt bei den Gliniden durch das Cytochrom P450-Enzymsystem: Nateglinid wird v. a. durch CYP2C9, Repaglinid v. a. durch CYP2C8 abgebaut. Bei der Elimination zeigen die Glinide ein gegensätzliches Verhalten: Die Ausscheidung der Metaboliten des Nateglinids erfolgt vorwiegend renal (über die Niere), während Metaboliten von Repaglinid vorwiegend biliär – d. h. über die Galle und letztlich den Stuhl – ausgeschieden werden.[1][3]
Klinische Angaben
Anwendungsgebiete (Indikationen)
Glinide werden bei Diabetes mellitus Typ 2 eingesetzt. Gemäß der Praxisleitlinie der Deutschen Diabetes-Gesellschaft[4] gehören sie dabei nicht zu Arzneistoffen der ersten Wahl, sondern können dann eingesetzt werden, wenn eine ausreichende Kontrolle des Stoffwechsels durch Diät, Gewichtsreduktion und körperliche Aktivität[5] und in der Monotherapie mit dem Biguanid Metformin nicht gelingt. Repaglinid ist neben der Kombination mit Metformin auch für die Monotherapie zugelassen, Nateglinid nur für die Kombinationstherapie mit Metformin.
Gegenanzeigen (Kontraindikationen)
Als insulinotrope Antidiabetika sind die Glinide bei Diabetes mellitus Typ 1 kontraindiziert. Bei diesen Patienten sind die β-Zellen der Bauchspeicheldrüse durch Autoimmunreaktionen zerstört, eine Insulinfreisetzung ist nicht mehr möglich. Weiterhin dürfen Glinide bei schweren Lebererkrankungen, bei diabetischer Ketoazidose sowie während Schwangerschaft und Stillzeit nicht eingesetzt werden. Wie bei allen Arzneimitteln darf kein Einsatz bei Patienten mit bekannter Überempfindlichkeit gegen Arzneistoffe oder Hilfsstoffe erfolgen.[6][7]
Bei Repaglinid ist zusätzlich die gleichzeitige Verwendung mit Gemfibrozil – ein Arzneistoff mit Wirkung auf die Blutfettwerte – kontraindiziert. Gemfibrozil ist ein potenter Inhibitor des Cytochrom P450-Isoenzyms CYP2C8, welches entscheidend am Abbau von Repaglinid beteiligt ist. Bei Hemmung dieses Enzyms durch Gemfibrozil-Einnahme steigen die Repaglinid-Plasmaspiegel um ein Vielfaches an, was mit einer unkontrollierbaren Verstärkung der blutzuckersenkenden Wirkung einhergeht.[6]
Wechselwirkungen mit anderen Medikamenten
Aufgrund des Wirkmechanismus und der Pharmakokinetik der Glinide können vielfältige Arzneimittelwechselwirkungen auftreten. So verstärken beispielsweise ACE-Hemmer die blutzuckersenkende Wirkung, während Diuretika, Corticosteroide oder Sympathomimetika zu einer verminderten Wirkung führen. Wie am Beispiel der Kontraindikation einer gleichzeitigen Einnahme von Repaglinid und Gemfibrozil dargestellt, können Inhibitoren und – analog Induktoren – der Cytochrom P450-Enzyme erheblichen Einfluss auf die Plasmaspiegel und somit die therapeutische Wirkung der Glinide nehmen.[6][7]
Unerwünschte Wirkungen (Nebenwirkungen)
Da die Insulinfreisetzung durch insulinotrope Antidiabetika unabhängig vom aktuellen Blutglucosespiegel ist, besteht bei Anwendung von Gliniden die Gefahr hypoglykämischer Reaktionen (Unterzuckerung). Aufgrund der kurzen Halbwertszeit der Glinide soll jedoch insbesondere die nächtliche Hypoglykämiegefahr geringer sein als bei den Sulfonylharnstoffen.[3] Weitere Nebenwirkungen beinhalten bei Nateglinid häufig, bei Repaglinid selten gastrointestinale Störungen wie Bauchschmerzen, Übelkeit, Erbrechen, Diarrhö sowie bei beiden Gliniden gleichermaßen selten auftretende Überempfindlichkeitsreaktionen (allergische Reaktionen), Erhöhungen von Leberenzymen und bei Repaglinid Sehstörungen.[6][7]
Zweckmäßigkeit von Gliniden
Glinide sollten ab Oktober 2010 auf Antrag des Gemeinsamen Bundesausschuss (G-BA) der Gesetzlichen Krankenversicherungen (GKV) nicht mehr erstattet werden, da der Nutzen nicht ausreichend durch Studien belegt sei. Das Bundesministerium für Gesundheit hatte diesen Antrag zum Verordnungsausschluss im März 2011 mit der Begründung abgewiesen, die Unzweckmäßigkeit und Unwirtschaftlichkeit der Glinide sei nicht nachgewiesen worden.[8][9][10]
Der G-BA hat in dieser Sache gegen das Bundesministerium für Gesundheit geklagt und den Prozess vor dem Landessozialgericht Berlin-Brandenburg mit einem inzwischen rechtskräftigen Urteil vom 27. Mai 2015 gewonnen. Am 18. Februar 2016 entschied der G-BA, die Verordnungseinschränkung durch Veröffentlichung im Bundesanzeiger zum 1. Juli 2016 in Kraft zu setzen. Von diesem Tag an können Glinide nur noch in medizinisch begründeten Einzelfällen zulasten der gesetzlichen Krankenversicherung verordnet werden.[11]
Handelsnamen
| Wichtiger Hinweis: Handelsnamen und Darreichungsformen von Arzneistoffen unterliegen keiner Standardisierung. Sie können sich daher in einzelnen Ländern unterscheiden. |
Die folgenden Arzneistoffe aus der Gruppe der Glinide sind derzeit im Handel für die Therapie verfügbar:
- Nateglinid: Starlix (A, D, CH), Starlix mite (CH), Trazec (A)
- Repaglinid: Repaglinid-Generika, NovoNorm (A, D, CH), Prandin (A)
- Mitiglinid: Glufast (J)
Einzelnachweise
- Aktories K., Förstermann U., Hofmann F., Starke K.: Allgemeine und Spezielle Pharmakologie und Toxikologie. 9. Auflage. Urban & Fischer Verlag/Elsevier Verlag, München/Jena 2006, ISBN 978-3-437-44490-6, S. 626–629.
- G-BA setzt Verordnungseinschränkung für Glinide in Kraft - Gemeinsamer Bundesausschuss. In: www.g-ba.de. Abgerufen am 6. Juni 2016.
- Mutschler E., Geisslinger G., Kroemer HK., Ruth P, Schäfer-Korting M.: Arzneimittelwirkungen. Lehrbuch der Pharmakologie und Toxikologie. 9. Auflage. Wissenschaftliche Verlagsgesellschaft. Stuttgart 2008. S. 419. ISBN 3-8047-1952-X.
- Deutsche-Diabetes-Gesellschaft: Diabetes mellitus Typ 2, Praxisleitlinie DDG (PDF; 856 kB), abgerufen am 23. Januar 2013.
- Richard Daikeler, Götz Use, Sylke Waibel: Diabetes. Evidenzbasierte Diagnosik und Therapie. 10. Auflage. Kitteltaschenbuch, Sinsheim 2015, ISBN 978-3-00-050903-2, S. 160 f.
- Rote Liste Online: Fachinformation NovoNorm® (Repaglinid), abgerufen am 22. September 2008.
- Rote Liste Online: Fachinformation Starlix® (Nateglinid), abgerufen am 22. September 2008.
- Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL):Glinide zur Behandlung des Diabetes mellitus Typ 2 (PDF; 474 kB) vom 17. Juni 2010.
- Schreiben des Bundesministeriums für Gesundheit an den G-BA (PDF; 179 kB) am 12. August 2010.
- Glinide weiterhin in Diabetestherapie einsetzbar (Memento des Originals vom 8. Oktober 2013 im Internet Archive) Info: Der Archivlink wurde automatisch eingesetzt und noch nicht geprüft. Bitte prüfe Original- und Archivlink gemäß Anleitung und entferne dann diesen Hinweis., Pressemitteilung diabetes.de März 2011, abgerufen 15. Februar 2012.
- Pressemitteilung des G-BA vom 18. Februar 2016, abgerufen am 13. April 2016.