Gemeine Becherjungfer
Die Gemeine Becherjungfer (Enallagma cyathigerum) ist eine Kleinlibellenart aus der Familie der Schlanklibellen (Coenagrionidae). Sie ist in der Wahl des Lebensraums relativ anspruchslos und besiedelt eine Vielzahl verschiedener Gewässertypen – langsam fließende Bäche, Weiher und Tümpel mit offener Wasserfläche sowie Moorenseen – und ist daher eine der am weitesten verbreiteten und auch häufigsten Libellen Europas. Von der IUCN wird sie als ungefährdet eingestuft. Das große Verbreitungsgebiet erstreckt sich über ganz Europa und weite Teile Asiens, wo es zur Ausformung von Populationen mit leicht unterschiedlichen Merkmalen kommt – sehr dunkel gefärbte Männchen mit ausgeweiteter schwarzer Zeichnung. Die Gemeine Becherjungfer ähnelt verschiedenen Arten der Azurjungfern (Coenagrion) und wird deshalb in älterer Literatur auch Becher-Azurjungfer genannt.
| Gemeine Becherjungfer | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|

Gemeine Becherjungfer (Enallagma cyathigerum), Männchen | ||||||||||||
| Systematik | ||||||||||||
| ||||||||||||
| Wissenschaftlicher Name | ||||||||||||
| Enallagma cyathigerum | ||||||||||||
| (Charpentier, 1840) |
Die Männchen der typischen, mittelgroßen Schlanklibelle haben eine hellblaue Grundfarbe mit schwarz abgesetzter Zeichnung, die Weibchen treten in blauer oder bräunlich grüner Farbvariante auf. Die Imagines sind zu einem temperaturabhängigen physiologischen Farbwechsel befähigt, bei dem die Körperfarbe bräunlich verdunkelt wird. Die Gemeine Becherjungfer lebt wie alle Libellenarten sowohl als Larve, wie auch als Imago räuberisch und ist für die sich aquatisch entwickelnden Larven auf Gewässer zur Eiablage angewiesen. Diese kann auch unter Wasser stattfinden.
Merkmale
Merkmale der Imagines
Die Gemeine Becherjungfer ist eine typische Schlanklibelle mit einer Körperlänge von 29–36 mm und einer Flügelspannweite von 40–45 mm. Die männlichen Imagines haben eine hellblaue Grundfarbe mit jeweils schwarzen Zeichnungen an den Segmentenden des Hinterleibs (Abdomen). Mittig auf der Oberseite des Vorderkörpers (Thorax) befindet sich ein breiterer schwarzer Mittelstreifen, dieser wird – bei den Männchen selten, bei Weibchen häufiger – von einer feinen hellen Mediannaht geteilt, das Merkmal kann aber sehr schwach ausgebildet sein oder ganz fehlen. Der Mittelstreifen wird beidseits von den hellblauen Antehumeralstreifen flankiert, diese sind mindestens so breit wie die dann folgenden schwarzen Humeralstreifen. Auf den darunterliegenden hellblauen Thoraxseiten befinden sich zwei kürzere schwarze Striche, der obere der beiden ist dabei nur sehr rudimentär oder gar nicht ausgebildet, so dass er ohne vergrößernde Betrachtung meist nicht wahrnehmbar ist.
.jpg.webp)
.JPG.webp)
.jpg.webp)
Auf dem zweiten Hinterleibssegment findet sich die namensgebende Zeichnung in Form eines gestielten Bechers – manchmal wird diese Figur auch als pilzförmig beschrieben. Sie ist allerdings recht variabel und kann daher nicht allein zur Bestimmung herangezogen werden. Die Zeichnung der Hinterleibssegmente drei bis fünf ist ähnlich, aber ausgedehnter und reicht an den Segmentseiten herunter. Auf dem sechsten und siebten Segment nimmt die Zeichnung dann fast die ganze Fläche ein. Die achten und neunten Hinterleibssegmente der männlichen Imagines sind wieder ganz blau und bilden damit ein auffallendes „Schlusslicht“.
Die Weibchen sind kräftiger gebaut; die schwarze, jeweils zu den vorderen Segmentstößen lanzettartig zugespitzte Zeichnung ist ausgedehnter als bei den Männchen. Vor dem Legebohrer, auf dem achten Hinterleibssegment, befindet sich ein abstehender Dorn. Wie in der Unterfamilie der Ischnurinae nicht ungewöhnlich, treten die Weibchen in verschiedenen Farbvarianten auf.[1] Es gibt androchrome, wie die Männchen gefärbte Weibchen, und grünliche oder hell bräunlich-graue Formen. Von letzteren ist noch nicht geklärt, ob es sich eventuell um die Jugendform der grünen Morphe handelt. Die Häufigkeitsverteilung der verschiedenen Farbmorphen variiert regional stark.[2]
Kurz nach der Umwandlung zur Imago sind die Libellen noch ohne Zeichnung – diese entwickelt sich erst innerhalb der nächsten Stunden. Auch die typische Blaufärbung wird erst während der Ausreifung in den folgenden Tagen gebildet. Diese Färbung ist nicht an Pigmente gebunden, sondern wird durch die Lichtbrechung an einer Suspension mikroskopischer Partikel (Tyndall-Effekt) vor einer schwarzen Pigmentschicht innerhalb der Epidermiszellen gebildet und von außen durch die durchsichtige Kutikula wahrgenommen.[3] Dadurch ist Enallagma cyathigerum zu einem physiologischen Farbwechsel befähigt, bei dem durch Pigmentwanderung in den Epidermiszellen die Körperfarbe bräunlich verdunkelt werden kann. Da dieser Effekt nur bei tiefen Außentemperaturen auftritt, dient er wahrscheinlich dem schnelleren Aufwärmen durch die höhere Absorption der Sonnenstrahlung in der dunklen Farbphase.[4]
Ähnliche Arten
.jpg.webp)
Die Gemeine Becherjungfer ähnelt verschiedenen Arten der Azurjungfern (Coenagrion) und wird deshalb in vielen älteren Bestimmungsbüchern auch Becher-Azurjungfer genannt. Sie gehört jedoch zur Gattung der Becherjungfern (Enallagma), so dass heute meist der die Gattung korrekt bezeichnende Name „Gemeine Becherjungfer“ verwendet wird. Gerade die Weibchen beider Gattungen können durch ihre sehr ähnlichen Zeichnungen leicht verwechselt werden. Ein sicheres Unterscheidungsmerkmal ist, neben dem abstehenden Dorn vor dem Legebohrer, die Zeichnung der Thoraxseiten. Bei Männchen wie Weibchen von Enallagma cyathigerum ist diese Fläche bis auf einen kleinen schmalen Strich zeichnungslos, bei den Azurjungfern und auch bei der ebenfalls ähnlichen Pokaljungfer (Erythromma lindenii) sind hier immer zwei deutlich ausgeprägte Striche zu erkennen. Braune Weibchen können an die Weibchen der Winterlibellen (Sympecma) erinnern.
Merkmale der Larven
Die Länge der Larven beträgt 14–18 mm, die der Kiemenblättchen zusätzlich noch einmal 6–7 mm.[5] Die Farbgebung des gesamten Körpers ist sehr variabel und reicht von grün bis dunkelbraun, wobei Exemplare aus Heidemooren eine besonders dunkle Färbung aufweisen können. Die Antennen des Kopfes gliedern sich in sechs, gelegentlich auch sieben, Segmente. Die Femora sind kurz vor dem Gelenk zur Tibia einmal gebändert, die Tibiae selbst sind nicht gezeichnet. Am Körperende befinden sich die hinten zugespitzten und im Vergleich zu Larven anderer Arten großen und, besonders an der Basis, breiten Kiemenblätter. Diese können mit bis zu drei dunkel abgesetzten Querbinden in der distalen Hälfte der Kiemenblättchen gezeichnet sein. Diese Zeichnung ist jedoch hochgradig variabel, die Binden variieren in der Intensität zwischen den Individuen und können auch ganz fehlen. Auf dem ersten bis hin zu zwei Dritteln der Gesamtlänge werden die abgeflachten Kiemenblättchen an den Kanten von kleinen Borsten gesäumt. Bei manchen ähnlichen Arten markiert eine Kerbe den Übergang zum nicht gesäumten Bereich; diese fehlt bei E. cyathigerum.[5] Die Kiemenblättchen können, auffällig gewedelt, als Drohgebärde gegen Artgenossen eingesetzt werden. Normalerweise sind die sehr aktiven Larven untereinander aber friedlich. Erbeutet werden in der Hauptsache Wasserfloh- und Zuckmückenlarven,[2] die Überwinterung erfolgt im vorletzten oder einem der davor liegenden Larvenstadien.[6] Die Larven der Gemeinen Becherjungfer ähneln den Larven anderer Kleinlibellen, sind jedoch deutlich transparenter. Sicheres Bestimmungsmerkmal ist eine kleine Nebenborste an der Basis der letzten Fangborste der Fangmaske.[6] Die Kiemenblättchen sind deutlich weniger spitz als die der Pechlibellen und dem Hinterkopf fehlt jegliche Fleckenzeichnung, wie sie für die Larven von Hufeisen- und Fledermaus-Azurjungfer typisch ist.[5]
Verbreitung und Lebensraum
Verbreitung
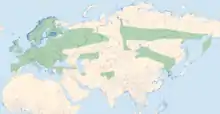
Das paläarktische Verbreitungsgebiet von Enallagma cyathigerum reicht vom Hohen Atlas bis Kamtschatka und nördlich über die Tundrazone und den Polarkreis bis zum Eismeer.[7] Erst in jüngerer Zeit wurde erkannt, dass die bisher ebenfalls zu E. cyathigerum gestellte nordamerikanische Population als eigene Art zu betrachten ist;[8] sie wird seither als Enallagma annexum geführt.[9] Auch wenn die Gemeine Becherjungfer damit ihren zirkumpolaren Status verloren hat, ist sie eine der am weitesten verbreiteten Libellenarten.[7] In Mitteleuropa ist die Art meist häufig, im Mittelmeerraum jedoch auf Berglagen beschränkt.[2]
Geographische Variation
Vor allem im Norden und Osten des Verbreitungsgebiets treten sehr dunkel gefärbte Männchen auf, die nicht in allen Merkmalen denen der mitteleuropäischen Populationen entsprechen. Bei ihnen ist die Zeichnung des Abdomens deutlich ausgedehnter, die lateral länglich ausgezogenen Streifen erinnern an die Sibirische Azurjungfer (Coenagrion hylas), die Antehumeralstreifen sind verengt oder sogar durchbrochen. Auf den, bei den mitteleuropäischen Vertretern, zeichnungslosen Thoraxseiten können sich zusätzliche dunkle Striche befinden.[7] Die nördlichen und südlichen Populationen in Sibirien sind zwar deutlich unterscheidbar, die Merkmale variieren aber entlang einer Kline von Norden nach Süden und tauchen in den gemäßigten Zonen Russlands so vermischt auf, dass eine Unterscheidung schwierig, wenn nicht gar unmöglich ist.[10]
Diese morphologische Variabilität führte zu einer Reihe von fehlerhaften Artbeschreibungen.[10] Auch wird der Status einiger Taxa als eigenständige Art oder Unterart der Gemeinen Becherjungfer – insbesondere bei Enallagma deserti und Enallagma risi – in der Literatur unterschiedlich betrachtet.
Eine Studie aus dem Jahr 2004, bei der Merkmale von mehr als 1.500 sibirischen Enallagma-Exemplaren untersucht wurden, kommt zum Schluss, dass Enallagma deserti, E. risi, E. strouhali und E. nigrolineata als Synonyme der polymorphen Gemeinen Becherjungfer zu betrachten sind. Nach dieser Studie wird in Sibirien einzig E. c. risi als Unterart anerkannt.[10] Eine weitere Studie aus dem Jahr 2002, die sechs Populationen des Enallagma cyathigerum-Komplexes aus Nordafrika, Europa, West- und Zentralasien anhand von DNA-Analyse und elektronenmikroskopischer Untersuchung der männlichen Hinterleibsanhänge untersuchte, kommt ebenfalls zu dem Schluss, dass die Taxa E. c. deserti und E. c. risi als Unterarten zur Gemeinen Becherjungfer zu stellen sind, wenn auch die Männchen anhand der Form der oberen Hinterleibsanhänge eindeutig zu unterscheiden sind. Darüber hinaus hybridisiert die Nominatform mit E. c. deserti, wie auch mit E. c. risi. Daraus wird geschlossen, dass sie erst seit kurzer Zeit divergieren.[11]
Andere Quellen sprechen Enallagma risi[12] und Enallagma deserti[13] aufgrund der deutlichen morphologischen Unterschiede Artstatus zu; so zeigt eine weitere Untersuchung aus Sibirien im Jahr 2010, dass E. cyathigerum und E. deserti gemeinsam in der untersuchten Gegend in der Ebene des Vasyugan vorkommen, jedoch nicht die gleichen Habitate besiedeln, woraus zusätzlich zu den morphologischen und jüngst untersuchten molekularen Unterschieden ein Artstatus für beide Taxa ableitet wird.[14] Auch in einer Studie, die für die Enallagma-Arten der gesamten Holarktis anhand der mitochondrialen DNA reifer männlicher Imagines ein Kladogramm erstellte, wird den nebeneinander gestellten Taxa Enallagma cyathigerum, E. deserti und E. risi Artrang zugesprochen und sie werden mit der japanischen Art Enallagma circatum zu einer paläarktischen Klade zusammengefasst.[15]
Auffällig ist, dass die weltweit über vierzig Arten zählende Gattung in Europa und dem kontinentalen Teil der Paläarktis[10] nur von der Gemeinen Becherjungfer – die als phylogenetisch junge Art erst vor stammesgeschichtlich kurzer Zeit hierher gelangte – und deren nahen Verwandten vertreten wird.[2]
Lebensraum
Die Gemeine Becherjungfer besiedelt eine Vielzahl verschiedener Gewässertypen, bevorzugt Stillgewässer mit offener Wasserfläche oder langsam fließende Gewässer, ist ansonsten aber anspruchslos. Als Pionierart findet sie sich oft an neu angelegten Seen, Gruben und Teichen. Verlandende Gewässer werden gemieden, auch an Gewässern mit hohem Fischbesatz ist Enallagma cyathigerum seltener – vermutlich wegen des hohen Fraßdrucks. Im norddeutschen Raum werden vorzugsweise Moorgewässer besiedelt, teilweise in hoher Dichte.[2] Enallagma cyathigerum ist weit verbreitet und häufig in großen Teilen von Europa und Nordasien. Im nördlichen Teil des Verbreitungsgebietes ist sie eine der häufigsten Libellen.[8]
Gefährdung und rechtliche Stellung
Die International Union for Conservation of Nature and Natural Resources (IUCN) stuft die Gemeine Becherjungfer als ungefährdet (least concern) ein.[8] In Deutschland steht sie unter keinem expliziten Schutz, ist aber wie alle Libellen nach Anhang 1 der Bundesartenschutzverordnung besonders geschützt.[16] Gemäß der Roten Liste der gefährdeten Libellen der Schweiz wird sie als nicht gefährdet eingestuft.[17] Eine zukünftige Bedrohung könnte sich durch Wasserverschmutzung und zunehmender Zerstörung von Lebensräume ergeben, wenn dadurch auch kein merklicher Einfluss auf die Gesamtpopulation zu erwarten ist.[8]
Lebensweise
.jpg.webp)
.jpg.webp)
.jpg.webp)
Die Hauptflugzeit der Imagines liegt zwischen Juni und August. Im Gegensatz zu anderen Kleinlibellen fliegt die Gemeine Becherjungfer oft über der freien Wasserfläche und nutzt hier die spärliche Vegetation, die nur wenige Zentimeter aus dem Wasser ragt, als Sitzwarte. Die Männchen halten ihre Körper dabei nahezu horizontal und sind durch dieses Spezifikum oft schon von weitem zu identifizieren. Wie die überwiegende Zahl der Kleinlibellen ist E. cyathigerum ein Lauerjäger, der potentielle Beute horizontal anfliegt, mit den Beinen ergreift und mit ihr auf die Sitzwarte zurückkehrt, um sie dort zu verzehren. Zum Beutespektrum gehören Klein- und Kleinstinsekten wie Stech- und Kriebelmücken, die Art hat aber keine spezifischen Ansprüche, sondern frisst alles, was sie überwältigen kann. Becherjungfern unternehmen zudem Suchflüge zum gezielten Beuteerwerb in der Gewässerrandvegetation. Hierbei werden auch sitzende Tiere, zum Beispiel Blattläuse, aufgenommen oder sogar gezielt Beute aus Netzen von Radspinnen gepflückt, ohne dabei in Kontakt mit dem Spinnennetz zu geraten.[18]
Fortpflanzung
Ab Mitte Mai suchen die ausgereiften Weibchen die Gewässer zur Fortpflanzung auf, wo sie von den Männchen schon erwartet werden. Häufig gelingt es einem Männchen, ein Weibchen schon zuvor abzupassen, so dass das Paar das Fortpflanzungsgewässer bereits als Tandem erreicht. Allein erscheinende Weibchen werden von den Männchen mit den Hinterleibsanhängen am Prothorax gepackt, dabei sind Hinterleibsanhänge und die Form des Prothoraxes artspezifisch aufeinander abgestimmt und greifen passgenau ineinander. Das Paar fliegt so verbunden dann zickzackförmig eine weitere Strecke, wobei es von anderen, bisher erfolglos gebliebenen, Männchen verfolgt wird. Diese versuchen das Tandem zu trennen, um selbst das Weibchen ergreifen zu können. Die Kopulation erfolgt sitzend in der Uferrandvegetation und kann zwischen zehn und sechzig Minuten dauern. Die Libellen bilden dazu ein Paarungsrad und krümmen ihre Abdomen zurück, so dass die Kopulationsorgane sich berühren und miteinander verankern können. Zuvor füllt das Männchen seine Samenblase und führt dazu den am Ende des Abdomens liegenden Samenausführgang zu seinem weiter vorn gelegenen Kopulationsorgan.
Bei der Kopulation räumt das Männchen vor der Spermaübertragung mit dem sekundären Begattungsorgan eventuell vorhandenes Sperma anderer Männchen aus vorhergehenden Begattungen aus. Dazu besitzt es an der Spitze des Penis Strukturen, mit denen es fremdes Sperma ergreifen und aus dem Genitaltrakt der Weibchen entfernen kann. Da die Eier erst unmittelbar vor der Eiablage befruchtet werden, verschafft es seinem eigenen Sperma hierdurch eine günstigere Position zur Befruchtung und sich selbst damit einen Reproduktionsvorteil.[19]
Eiablage
Nach der Paarung fliegt das Paar im Tandemflug auf die offene Wasserfläche hinaus, um mit der Eiablage zu beginnen. Es setzt sich auf kurz über die Wasseroberfläche hinausragende Pflanzen ab, wo das Weibchen mit seinem Legebohrer die Eier in lebendes oder totes pflanzliches Gewebe bohrt und so bis zu acht Eier pro Minute legt. Das Männchen bleibt dabei zunächst am Weibchen angekoppelt, welches während der Eiablage regelmäßig rückwärts unter Wasser abtaucht. Sobald das Weibchen vollständig unter Wasser ist, trennt das Männchen die Verbindung. Das Weibchen dreht sich dann um und steigt kopfüber weiter unter Wasser, während es die Eier in einer unregelmäßigen Zickzacklinie in die Wasservegetation einbohrt. Dabei wechselt es geschickt auch auf andere Pflanzen über und kann bis zu 90 Minuten unter Wasser verbleiben. Dies ist die längste bisher bei einer Libelle festgestellte Tauchzeit.[2] Geschützt wird das Tier dabei von der physikalischen Kieme, einer feinen Luftschicht, die die getauchte Libelle umgibt, und ihr die Atmung unter Wasser erlaubt. Verbrauchter Sauerstoff wird in der Luftschicht durch Diffusion aus dem Wasser ersetzt, während das entstandene Kohlendioxid zurück diffundiert. Durch rollende Bewegungen um die Körperlängsachse kann dieser Luftaustausch bei Bedarf noch gesteigert werden.[20]
Unter Wasser sind die Weibchen einem hohen Fraßdruck durch Räuber ausgesetzt, aber auch der Gefahr, nach dem Auftauchen von der Oberflächenspannung des Wassers festgehalten zu werden und nicht mehr auffliegen zu können. Die Weibchen von Enallagma cyathigerum versuchen daher, möglichst ihren gesamten Eivorrat während eines einzigen Tauchgangs abzulegen.[2] Das Männchen erwartet die Rückkehr seiner Partnerin normalerweise an der Wasseroberfläche und versucht so, die erneute Paarung mit einem weiteren Männchen zu verhindern. Nach dem Auftauchen des Weibchens koppelt es sich erneut an, um es zu einer weiteren Eiablagestelle zu bringen. Gelingt es nicht, das Weibchen aus dem Wasser zu ziehen, versuchen beide das nächste Emerssubstrat zu erreichen. Dabei zieht das Männchen seine Partnerin, von dieser durch Schlagen mit den Vorderflügeln unterstützt, durch das Wasser. Die so erreichte Geschwindigkeit kann bis zu zehn Zentimeter pro Sekunde betragen.[2]
Bisweilen verlässt das Männchen die Abtauchstelle des Weibchens auch direkt, um zu versuchen, sich mit einem weiteren Weibchen zu paaren. Das wieder aufgetauchte Weibchen macht, sofern es nicht selbständig aus dem Wasser starten kann, mit charakteristischen Bewegungen des Abdomens auf sich aufmerksam, so dass es meist schon nach kurzer Zeit von einem der in hoher Dichte fliegenden Männchen gefunden wird.
Larvalentwicklung
Zwei bis drei Wochen nach der Eiablage schlüpfen die Larven. Bis zur Umwandlung zur Imago durchlaufen die Larven zehn bis zwölf Häutungsstadien, in Mitteleuropa meist innerhalb eines Jahres. In kühlen Berglagen kann die Entwicklung auch bis zu vier Jahren dauern. Die Larve überwintert in einem der letzten Häutungsstadien.
Die Schlüpfperiode liegt zwischen Ende April und Anfang September mit der größten Schlupfrate im Juni. Im Gegensatz zu vielen anderen Kleinlibellenlarven, die zum Schlüpfen an das seichte Ufer wandern, nutzt Enallagma cyathigerum meist senkrechte Halme der offenen Wasservegetation. Der Schlupf erfolgt dann nur wenige Zentimeter über der Wasserfläche.
Systematik
Die Gemeine Becherjungfer wurde 1840 von Toussaint von Charpentier als Agrion cyathigerum in seinem Werk Libellulineae Europaeae erstbeschrieben. Sie wird innerhalb der Schlanklibellen in die Gattung der Becherjungfern (Enallagma) gestellt, die ebenfalls 1840 von Toussaint von Charpentier angelegt wurde. Enallagma cyathigerum ist Typusart der Gattung.
Der wissenschaftliche Name bezieht sich auf „Enallagma“ (griech. Vertauschung) und wurde von Charpentier ursprünglich für alle blauen und schwer unterscheidbaren Schlanklibellen gewählt. Das Artepitheton cyathigerum (lat.) bildet sich aus „cyathus“ (griech. Lehnwort Becher) und -ger(um) (lat. tragend).[2]
Literatur
- Klaus Sternberg, Rainer Buchwald (Hrsg.): Die Libellen Baden-Württembergs. Band 1: Allgemeiner Teil, Kleinlibellen (Zygoptera). Verlag Eugen Ulmer, Stuttgart 1999, ISBN 3-8001-3508-6.
- Klaas-Douwe B. Dijkstra: Field Guide to the Dragonflies of Britain and Europe. British Wildlife Publishing, Gillingham 2006, ISBN 0-953139948.
- Heiko Bellmann: Der Kosmos-Libellenführer. Die Arten Mitteleuropas sicher bestimmen. Franckh-Kosmos-Verlag, Stuttgart 2007, ISBN 978-3-440-10616-7.
- Gerhard Jurzitza: Der Kosmos-Libellenführer. Die Arten Mittel- und Südeuropas. Franckh-Kosmos-Verlag, Stuttgart 2000, ISBN 3-440-08402-7.
- Steve Cham: Field Guide to the larvae and exuviae of British Dragonflies. Shrewsbury, The British Dragonfly Society, Peterborough 2012, ISBN 978-0-9556471-2-3.
Weblinks
- Bild eines deutlich dunkel gefärbten Männchens aus Jakutien auf naturfotografen-forum.de
Einzelnachweise
- Jill Silsby: Subfamily Ischnurinae (Blue-tailed Damselflies). In Dragonflies of the World. Smithsonian, Washington 2001, ISBN 1-560-98959-9, S. 110–112.
- K. Sternberg, F.-J. Schiel: Enallagma cyathigerum. In Sternberg, Buchwald: Die Libellen Baden-Württembergs. Band 1, S. 300 ff.
- K. Sternberg: Bau und Funktion des Libellenkörpers – Körperfarbe. In Sternberg, Buchwald: Die Libellen Baden-Württembergs. Band 1, S. 91 ff.
- K. Sternberg: Thermoregulation. In Sternberg, Buchwald: Die Libellen Baden-Württembergs. Band 1, S. 133 ff.
- Steve Cham: Common Blue Damselfly Enallagma cyathigerum. In Field Guide to the larvae and exuviae of British Dragonflies, S. 82–85.
- Heiko Bellmann: Becher-Azurjungfer. In Der Kosmos-Libellenführer. Die Arten Mitteleuropas sicher bestimmen, Franckh-Kosmos-Verlag, Stuttgart 2007, ISBN 978-3-440-10616-7, S. 142–143.
- Reinhard Jödicke: Enallagma cyathigerum (Charpentier, 1840). In Dijkstra: Field Guide to the Dragonflies of Britain and Europe, S. 101–103.
- Enallagma cyathigerum in der Roten Liste gefährdeter Arten der IUCN 2010.4. Eingestellt von: R. Dow, 2007. Abgerufen am 22. August 2013.
- Dennis Paulson: Northern Bluet. In Dragonflies and Damselflies of the East, S. 95–97.
- A. Yu. Haritonov: The composition and History of Siberian Odonate Fauna. S. 73–87. In B. K. Tyagi (Hrsg.): Odonata. Biology of Dragonflies. Scientific Publishers (India), Jodhpur 2007, ISBN 978-81-7233-482-6.
- B. Samroui, P. H. H. Weekers, H. J. Dumont: The Enallagma of the western and central Palearctic (Zygoptera: Coenagrionidae). In: Odonatologica 31(4), 2002, S. 371–381. ISSN 0375-0183.
- Asmus Schröter: The Odonata of Kyrgyzstan, part I - Critical nation checklist, annotated list of records and collected data of the summer half-years 2008 and 2009, International Dragonfly Fund - Report 28 (2010): 1–72.
- Reinhard Jödicke: Enallagma deserti (Selys, 1871). In Dijkstra: Field Guide to the Dragonflies of Britain and Europe, S. 102–102.
- R. Bernard, O. E. Kosterin: Biogeographical and ecological Description of the Odonata of eastern Vasyugan Plain, west Siberia, Russia In: Odonatologica 39(1), 2010.
- Julie Turgeon, Robby Stoks, Ryan A. Thum, Jonathan M. Brown und Mark A. McPeek: Simultaneous Quaternary Radiations of Three Damselfly Clades across the Holarctic. The American Naturalist, 165, 4, 2005, S. 78–107.
- Anlage 1 der Bundesartenschutzverordnung
- Rote Liste der gefährdeten Arten der Schweiz: Libellen. In: Bundesamt für Umwelt der Schweiz. Abgerufen am 23. September 2013.
- Christine Fischer: Enallagma cyathigerum und Ischnura elegans als Kleptoparasiten in Spinnennetzen (Odonata: Coenagrionidae). In Libellula, Zeitschrift der Gesellschaft deutschsprachiger Odonatologen e.V. 28 (3/4) 2009, ISSN 0723-6514.
- A. Martens: Fortpflanzungsverhalten der Libellen – Liebe im Rad. In Sternberg, Buchwald: Die Libellen Baden-Württembergs. Band 1, S. 146 ff.
- A. Martens: Fortpflanzungsverhalten der Libellen – Unterwassereiablage. In Sternberg, Buchwald: Die Libellen Baden-Württembergs. Band 1, S. 156.