Friedlaender-Chinolin-Synthese
Die Friedlaender-Chinolin-Synthese, auch Friedlaender-Kondensation genannt, ist eine Namensreaktion der organischen Chemie. Sie wird vornehmlich zur Herstellung von Chinolin eingesetzt und ist nach dem deutschen Chemiker Paul Friedlaender (1857–1923)[1] benannt.
Übersichtsreaktion
Bei der Friedlaender-Chinolin-Synthese reagieren aromatische Aldehyde oder Ketone mit Aldehyden oder Keton zu Chinolen.
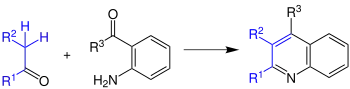
Die Reste R1–R3 können sowohl Wasserstoffatome als auch Organylreste sein. Die Synthese wird von Säuren oder Basen katalysiert. Wobei Säuren vermutlich besser funktionieren.[2] Außerdem muss die Reaktion immer in Lösungsmitteln durchgeführt werden, da sie sonst drastische Bedingungen, wie zum Beispiel Temperaturen von bis zu 200 °C, erfordern würde. Bei genaueren Untersuchungen wurde festgestellt, dass es zwei eindeutige Schritte gibt, in denen die Reaktion abläuft:
1. Kondensation der Aminogruppe mit der Carbonylgruppe
2. intramolekulare Aldolkondensation.[2]
Beide Schritte verlaufen unter Wasserabspaltung.
Mechanismus
Die hier vorgestellte Variante ist die basenkatalysierte Reaktion. Es existiert daneben auch eine säurekatalysierte Reaktion. Die Pfitzinger-Reaktion und die Niementowski-Chinolin-Synthese basieren auf dem Konzept des hier vorgestellten Mechanismus der Friedlaender-Chinolin-Synthese:[3]

Zunächst wird die Carbonylverbindung 1 mit einer Base (B) versetzt. Diese entzieht dem Aldehyd oder Keton ein Proton in α-Stellung zur Carbonylgruppe. Dadurch bildet sich ein Enolat 2. Dieses Molekül greift nun mit den Elektronen der ausgebildeten Doppelbindung das Kohlenstoffatom der Carbonylgruppe am aromatischen Sechsring 3 an, wodurch die Carbonylgruppe von Molekül 3 in ein Alkoholat 4 übergeht. Dieses Alkoholat entzieht der protonierten Base aus Schritt 2 ein Proton und wird so zu einem Alkohol. Durch Wasserabspaltung bildet sich aus 5 dann die α,β-ungesättigte Carbonylverbindung 6. Nun findet bei 6 ein intramolekularer Angriff der Aminogruppe auf die verbleibende Carbonylgruppe statt, wodurch sich ein zweiter Sechsring im Molekül ausbildet 7. Somit handelt es sich beim Molekül 7 um eine bicyclische Verbindung. Die Aminogruppe und das Alkoholat des neu gebildeten heterocyclischen Sechsringes führen einen Protonentransfer durch. Die so aus einem Alkoholat entstehende Hydroxygruppe greift nun das Wasserstoffatom am Stickstoffatom von 8 an, wodurch sich auch diese Hydroxygruppe in Form von Wasser abscheidet. Somit bildet sich Chinolinderivat 9.
Anwendung
Die Friedlaender-Chinolin-Synthese wird dazu verwendet, Chinoline, Naphthyridine und andere polycyclische heterocyclische Derivate – in meist hohen Ausbeuten – herzustellen.[2]
Einzelnachweise
- Winfried R. Pötsch u. a.: Lexikon bedeutender Chemiker. Bibliographisches Institut, Leipzig 1998, ISBN 3-323-00185-0, S. 157–158.
- Zerong Wang: Comprehensive Organic Name Reactions and Reagents. John Wiley & Sons, New Jersey 2009, ISBN 978-0-471-70450-8, S. 1137–1141 (englisch).
- nach: B. P. Mundy, M. G. Ellerd, F. G. Favaloro: Name Reactions and Reagents in organic Synthesis. 2. Auflage, Wiley-Interscience, Hoboken, NJ 2005, ISBN 978-0-471-22854-7, S. 258.