Festkörperakkumulator
Ein Festkörperakkumulator, auch Feststoffbatterie oder Festkörperbatterie genannt, ist eine spezielle Bauform von Akkumulatoren, bei der beide Elektroden und auch der Elektrolyt aus festem Material bestehen.
Aufbau und Funktion
Festkörperakkumulatoren unterscheiden sich insbesondere durch den festen Elektrolyten von den herkömmlichen Akkumulatoren. Die Aufgabe des Elektrolyten ist die Leitung von Ionen zwischen Anode und Kathode. Je nach Zellchemie ist das zu leitende Ion unterschiedlich, beispielsweise in Lithium-Ionen-Batterien das Lithium-Kation oder in Natrium-Ionen-Batterien das Natrium-Kation. Häufig beruht der Ladungstransport in Festelektrolyten auf verschiedenen Sprung-Prozessen im Festkörpergitter.[1] Die Ausprägung dieser Prozesse ist je nach verwendetem Elektrolyten unterschiedlich und hängt auch von der Ausbildung verschiedener Defekte, wie etwa Schottky-Defekten, Frenkel-Defekten oder besetzten Zwischengitterplätzen ab.[1]
Zur Verwendung von Festelektrolyten in Festkörperbatterien sollten diese eine möglichst hohe Ionenleitfähigkeit sowie eine sehr geringe elektrische Leitfähigkeit aufweisen. Damit Festkörperbatterien die Energiedichten von herkömmlichen Akkumulatoren übertreffen können, müssen metallische Anoden zur Anwendung kommen. Im Falle einer Lithium-Ionen-Batterie müsste also metallisches Lithium statt des bisher eingesetzten Graphits verwendet werden. Metallisches Lithium neigt bei der Zyklisierung der Batterie zur Bildung von Dendriten. Dendriten können von der Lithium-Anode bis zur Kathode wachsen und dadurch einen elektrischen Kurzschluss verursachen. Das ist auch der Grund, warum der Einsatz von metallischem Lithium in herkömmlichen Batterien bisher nicht möglich war. Weitere Anforderungen an Festelektrolyten sind daher eine gute Stabilität gegenüber Lithium sowie gegen die Ausbildung von Dendriten.[2] Die Gründe für die Bildung von Dendriten in Lithium-Ionen-Festkörperbatterien sind bislang noch nicht vollständig geklärt und werden intensiv erforscht.[3]
Die verwendeten Materialklassen für Lithium-Ionen-Festkörperbatterien können unterschiedlich klassifiziert werden. Häufig erfolgt eine Einteilung in die drei Materialklassen: polymere, sulfidische oder oxidische Elektrolyte.[4]
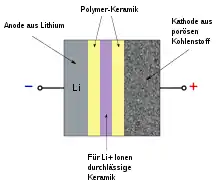
Gegenwärtige Lithium-Luft-Festkörperakkumulatoren verwenden eine Anode aus Lithium, einen Elektrolyten, der entweder aus einer Keramik bzw. aus Glas oder aber aus einem Glas-Keramik-Kompositmaterial besteht, sowie eine Kathode aus porösem Kohlenstoff. Die Anode und Kathode sind i. d. R. vom Elektrolyten durch Polymer-Keramik-Verbundstoffe getrennt, die den Ladungstransfer an der Anode verbessern und die Kathode elektrochemisch mit dem Elektrolyten verbinden. Die Polymer-Keramik-Verbundstoffe dienen dazu, den Widerstand zu verringern.[5]
Beispiele für solche Ionenleiter sind Ag4RbI5 für den Ladungstransport von Ag+-Ionen und LiI/Al2O3-Mischungen für den Ladungstransport von Li+-Ionen.
Eigenschaften
Festkörperakkumulatoren weisen grundsätzlich die folgenden beiden Eigenschaften auf: niedrige Leistungsdichte und hohe Energiedichte. Die erste Beschränkung tritt wegen der Schwierigkeit auf, hohe Ströme über Festkörper-Festkörper-Grenzflächen zu übertragen. Andererseits haben diese Akkumulatoren gewisse Vorteile, die diesen Nachteil aufwiegen: Sie sind leicht zu miniaturisieren (sie können z. B. in Form einer dünnen Schicht gefertigt werden), und die Gefahr, dass der Elektrolyt durch Undichtigkeiten den Akkumulator beschädigen könnte, besteht nicht. Sie haben in der Regel eine sehr lange Lebensdauer und Lagerfähigkeit und zeigen gewöhnlich auch bei Temperaturschwankungen (die bei flüssigen Elektrolyten zu Einfrieren oder Sieden des Elektrolyten führen können) keine abrupten Veränderungen ihrer Leistung. Als weiterer Vorteil von Festkörperakkumulatoren (im Gegensatz zu Lithium-Ionen-Akkumulatoren) kommt hinzu, dass sie nicht entflammbar sind.[6]
Der Hauptnachteil von Festkörperakkumulatoren ist die geringe Ionen-Leitfähigkeit der meisten Glas-Keramik-Elektrolyten. Die Ionen-Leitfähigkeit der gegenwärtigen Festkörper-Elektrolyten ist noch immer geringer als die Ionen-Leitfähigkeit von flüssigen Elektrolyten.[5]
Die Volumen-Leistungs-Dichte bestimmt die Größe, die Masse-Leistungs-Dichte das Gewicht der Zellen. Bei der Elektromobilität spielt diese eine wesentliche Rolle. Das Ragone-Diagramm verdeutlicht den Zusammenhang zwischen Leistungsdichte und Energiedichte. Laut IBM-Forschern liegt die theoretisch erreichbare spezifische Energie der Lithium-Luft-Akkumulatoren (ohne Gewicht des Luftsauerstoffes) bei mehr als 11 kWh pro Kilogramm (kWh/kg). Die Forscher glauben, dass eine praktisch ausgeführte Lithium-Luft-Batterie etwa ein Zehntel dieses theoretischen Maximalwertes erreichen könnte.[7]
Anwendung
Die Firma Mercedes-Benz verwendet Festkörperakkumulator auf Lithium-Basis in ihrem eCitaro. Der Energieinhalt der Batterien beträgt 252 bis 441 kWh, aufgeteilt in vier bis sieben Module. Seit Februar 2021 werden diese Busse von der ESWE Verkehrsgesellschaft in Wiesbaden regulär eingesetzt.[8]
Bisherige Lithium-Ionen-Akkumulatoren
Zu den Nachteilen von gegenwärtigen Lithium-Ionen-Akkumulatoren gehören z. B. notwendige Kühl- und sonstige Vorrichtungen, die mehr als die Hälfte des Volumens eines Lithium-Ionen-Akkumulators ausmachen können. Zudem sind die meisten flüssigen Elektrolyte brennbar, was zusätzliche Sicherheitsvorrichtungen erfordert. Um die Lebensdauer der Elektroden zu verlängern, muss der Akkumulator auch noch gekühlt werden, und es muss verhindert werden, dass der Akkumulator gänzlich geladen bzw. entladen wird.[9] Die Festkörperakkumulatoren der Firma Sakti3 basieren prinzipiell zwar noch immer auf der Lithium-Ionen-Technologie, jedoch wird der flüssige Elektrolyt hierbei durch eine dünne Schicht eines Festkörperelektrolyten ersetzt, der unbrennbar ist. Einige Prototypen waren ziemlich robust und überstanden Tausende von Lade-Entlade-Zyklen.[9]
Weblinks
Einzelnachweise
- Zhonghui Gao, Huabin Sun, Lin Fu, Fangliang Ye, Yi Zhang: Promises, Challenges, and Recent Progress of Inorganic Solid-State Electrolytes for All-Solid-State Lithium Batteries. In: Advanced Materials. Band 30, Nr. 17, April 2018, S. 1705702, doi:10.1002/adma.201705702 (wiley.com [abgerufen am 18. Dezember 2019]).
- Kian Kerman, Alan Luntz, Venkatasubramanian Viswanathan, Yet-Ming Chiang, Zhebo Chen: Review—Practical Challenges Hindering the Development of Solid State Li Ion Batteries. In: Journal of The Electrochemical Society. Band 164, Nr. 7, 2017, ISSN 0013-4651, S. A1731–A1744, doi:10.1149/2.1571707jes (ecsdl.org [abgerufen am 18. Dezember 2019]).
- Fudong Han, Andrew S. Westover, Jie Yue, Xiulin Fan, Fei Wang: High electronic conductivity as the origin of lithium dendrite formation within solid electrolytes. In: Nature Energy. Band 4, Nr. 3, März 2019, ISSN 2058-7546, S. 187–196, doi:10.1038/s41560-018-0312-z (nature.com [abgerufen am 18. Dezember 2019]).
- Joscha Schnell, Till Günther, Thomas Knoche, Christoph Vieider, Larissa Köhler: All-solid-state lithium-ion and lithium metal batteries – paving the way to large-scale production. In: Journal of Power Sources. Band 382, April 2018, S. 160–175, doi:10.1016/j.jpowsour.2018.02.062 (elsevier.com [abgerufen am 18. Dezember 2019]).
- Binod Kumar, Jitendra Kumar: Cathodes for Solid-State Lithium–Oxygen Cells: Roles of Nasicon Glass-Ceramics. In: Journal of The Electrochemical Society. Band 157, Nr. 5, 5. Januar 2010, S. A611–A616, doi:10.1149/1.3356988.
- Infinite Power Solutions stellt papierdünnen Akku vor. In: elektroniknet.de. 6. Juni 2012, abgerufen am 2. November 2013.
- Das Battery 500-Projekt: 800 km Reichweite für Elektroautos. IBM, abgerufen am 12. Dezember 2013.
- Marcel B: ESWE Wiesbaden nimmt 21 eCitaro in Betrieb. 2. Februar 2021, abgerufen am 23. Oktober 2021 (deutsch).
- Kevin Bullis: Solid-State Batteries. In: MIT Technology Review. Mai 2011, abgerufen am 2. November 2013.