Essigsäureisopentylester
Essigsäureisopentylester ist eine chemische Verbindung aus der Gruppe der Carbonsäureester, genauer der Essigsäurepentylester.
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
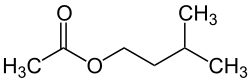 | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Essigsäureisopentylester | |||||||||||||||
| Andere Namen | ||||||||||||||||
| Summenformel | C7H14O2 | |||||||||||||||
| Kurzbeschreibung |
wenig flüchtige, farblose Flüssigkeit mit fruchtig/bananenartigem Geruch[2] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 130,19 g·mol−1 | |||||||||||||||
| Aggregatzustand |
flüssig[2] | |||||||||||||||
| Dichte |
0,87 g·cm−3[2] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Siedepunkt |
142 °C[2] | |||||||||||||||
| Dampfdruck | ||||||||||||||||
| Löslichkeit |
wenig löslich in Wasser (2,12 g·l−1 bei 19,4 °C)[2] | |||||||||||||||
| Brechungsindex |
1,400 (20 °C)[3] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Toxikologische Daten | ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | ||||||||||||||||
Vorkommen
Essigsäureisopentylester ist eine der Hauptkomponenten des Bananenaromas[4] und ein wichtiger Aromastoff in Bier.[5] Es wurde auch in einer Vielzahl anderer Früchte und weiterer Lebensmittel, vor allem Gärungsgetränken, als Aromastoff nachgewiesen.[6] Bienen geben die Verbindung vor einem Angriff ab, es ist also ein Alarmpheromon.[7]
Gewinnung und Darstellung
Essigsäureisopentylester (2) kann durch Veresterung von Isoamylalkohol (1) mit Essigsäure gewonnen werden:[8]
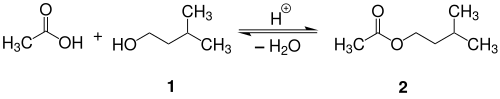
Diese säurekatalysierte Gleichgewichtsreaktion kann auf die Seite des Esters 2 verschoben werden, indem das entstehende Wasser dem Reaktionsgemisch entzogen wird.
Eigenschaften
Essigsäureisopentylester ist eine wenig flüchtige, entzündbare, farblose Flüssigkeit mit fruchtigem Geruch, die wenig löslich in Wasser ist.[2]
Biologiogische Bedeutung
Essigsäureisopentylester ist neben 2-Octanol[9] und anderen Substanzen ein Alarmpheromon der Honigbiene.[10]
Sicherheitstechnische Kenngrößen
Essigsäureisopentylester bildet leicht entzündliche Dampf-Luft-Gemische. Die Verbindung hat einen Flammpunkt von 35 °C.[2] Der Explosionsbereich liegt zwischen 1 Vol.‑% (53 g/m3) als untere Explosionsgrenze (UEG) und 9 Vol.‑% (485 g/m3) als obere Explosionsgrenze (OEG).[2][11] Der untere Explosionspunkt liegt bei 33 °C.[2] Die Zündtemperatur beträgt 380 °C.[2][11] Der Stoff fällt somit in die Temperaturklasse T2.
Verwendung
Essigsäureisopentylester wird durch seinen Geruch nach Bananen als Bananenaroma verwendet.[7] Früher wurde die Hefner-Kerze als Lichtnormal verwendet, die als Brennstoff iso-Amylacetat = Essigsäureisopentylester oder eine Mischung von Pentylester der Essigsäure nutzte.[12] Zudem wird es auch wegen seines starken Geruchs zur Dichtheitsprüfung von militärischen Gasschutzmasken verwendet.[13]
Einzelnachweise
- Eintrag zu ISOAMYL ACETATE in der CosIng-Datenbank der EU-Kommission, abgerufen am 21. März 2020.
- Eintrag zu CAS-Nr. 123-92-2 in der GESTIS-Stoffdatenbank des IFA, abgerufen am 21. September 2018. (JavaScript erforderlich)
- Datenblatt Isoamyl acetate, natural, ≥97%, FCC, FG bei Sigma-Aldrich, abgerufen am 20. September 2015 (PDF).
- Marshall J. Myers, Phillip Issenberg, Emily L. Wick: l-Leucine as a precursor of isoamyl alcohol and isoamyl acetate, volatile aroma constituents of banana fruit discs. In: Phytochemistry. 9, 1970, S. 1693, doi:10.1016/S0031-9422(00)85580-6.
- Prof. Dr. Werner Back: Mikrobiologie der Lebensmittel Band 5: Getränke. Behr's Verlag DE, 2008, ISBN 978-3-89947-956-0, S. 144 (eingeschränkte Vorschau in der Google-Buchsuche).
- Eintrag zu Isopentylacetat. In: Römpp Online. Georg Thieme Verlag, abgerufen am 21. September 2015.
- Jeff Potter: Kochen für Geeks Inspiration & Innovation für die Küche; [Rezepte und wissenschaftliche Abenteuer]. O'Reilly Germany, 2011, ISBN 978-3-86899-125-3, S. 96 (eingeschränkte Vorschau in der Google-Buchsuche).
- Hermann Sahm, Garabed Antranikian, Klaus-Peter Stahmann, Ralf Takors: Industrielle Mikrobiologie. Springer-Verlag, 2014, ISBN 978-3-8274-3040-3, S. 265 (eingeschränkte Vorschau in der Google-Buchsuche).
- W.M. Getz, R.P. Akers: Olfactory response characteristics and tuning structure of placodes in the honey bee Apis mellifera L. In: Apidologie volume 206, page530 (1965). Band 24, 1993, S. 195–217, doi:10.1051/apido:19930303. abgerufen am 31. Dezember 2021
- D. A. Shearer, R. Boch: 2-Heptanone in the Mandibular Gland Secretion of the Honey-bee. In: Nature. Band 206, 1965, S. 530, doi:10.1038/206530a0. abgerufen am 31. Dezember. 2021.
- E. Brandes, W. Möller: Sicherheitstechnische Kenngrößen – Band 1: Brennbare Flüssigkeiten und Gase, Wirtschaftsverlag NW – Verlag für neue Wissenschaft GmbH, Bremerhaven 2003.
- H. Lux, Das moderne Beleuchtungswesen abgerufen am 28. November 2018.
- Occupational Safety and Health Administration: Fit Testing Procedures (Mandatory). - 1910.134 App A | Occupational Safety and Health Administration, abgerufen am 17. Januar 2020.
