Entglasung
Entglasung oder Devitrifikation bezeichnet den Vorgang, bei dem sich in einem Glas partiell Kristalle bilden, die weiterhin von einer amorphen Glasmatrix umgeben sind oder bei dem das Glas vollständig auskristallisiert und damit seine Glaseigenschaften verliert.
Bei der Herstellung von Glas gilt eine Entglasung meist als Fehler der Schmelzmasse, kann jedoch auch bewusst herbeigeführt werden, um spezielle Eigenschaften zu erzielen. Häufigstes Beispiel hierfür sind Glaskeramiken.[1] Entglasung kann auch bei natürlichen Gläsern auftreten, etwa bei Obsidian.
Kristallisation in Gläsern
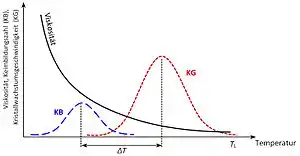
Unter bestimmten Temperatur-Zeit-Bedingungen kommt es in Gläsern zur Kristallisation. Voraussetzung hierfür ist das Vorhandensein oder die Bildung von Kristallisationskeimen. Das Wachstum von Keimen geschieht durch Herandiffundieren von Kristallbestandteilen und deren Aufbau zu Kristallen. Bei herkömmlichen Gläsern liegt die maximale Keimbildungszahl (KB) bei tieferen Temperaturen als deren maximale Wachstumsgeschwindigkeit (KG). Letztere wird maßgeblich durch die Diffusionsgeschwindigkeit bestimmt, die bei geringeren Viskositäten stark ansteigt. Je näher die Temperaturen der maximalen Keimbildungszahl und der maximalen Wachstumsgeschwindigkeit beieinander liegen bzw. je größer der Überlappungsbereich der beiden Kurven ist, umso schneller muss die Abkühlung erfolgen, um eine Kristallisation zu vermeiden. Bei vielen Metallen liegen diese beiden Kurven direkt übereinander, damit gibt es einen Temperaturbereich, in dem das Metall schlagartig auskristallisiert. Daher müssen zur Herstellung metallischer Gläser aus einer Schmelze Abkühlgeschwindigkeiten von bis zu 108 Kelvin pro Sekunde erreicht werden, um Kristallisation zu unterbinden.[2][3]
Im Regelfall einer Glasproduktion geschieht die Abkühlung des Glases schnell genug, was zu einem starken Anstieg der Viskosität der Schmelze führt. Die zunehmende Viskosität der Schmelze verhindert die Diffusion zunehmend, bis das Wachstum von Kristallen vollkommen zum Erliegen kommt. Die schnelle Abkühlung der Schmelze ist somit eine Grundvoraussetzung, um einen Festkörper glasig zu erhalten. Triebkraft der Kristallisation ist das Bestreben der Materie, den Zustand niedrigster Energie einzunehmen. Gläser befinden sich aufgrund ihrer regellosen Struktur in einem metastabilen – also energiereicheren – Zustand als Kristalle.
Homogene Keimbildung und kritischer Keimradius
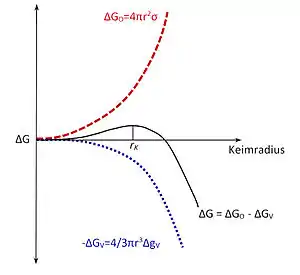

Thermodynamisch betrachtet findet während der Keimbildung in einem System eine Änderung der freien Enthalpie statt. Dieser Vorgang wird immer dann ablaufen, wenn dabei die freie Enthalpie verringert wird. Während der Keimbildung ordnen sich die Bausteine zu einem Kristall und geben dadurch Energie ab. Dieser Vorgang ist mit einem Phasenübergang von der flüssigen Schmelze zum festen Kristall verbunden. Es entsteht also eine Grenzfläche, zu deren Erzeugung Energie aufgebracht werden muss. Die Gesamtänderung der freien Enthalpie setzt sich also aus einem Volumenanteil , bei dem Energie abgegeben wird, und einem Oberflächenanteil , der zur Schaffung der Grenzfläche aufgebracht werden muss, zusammen. Es ergibt sich der folgende Zusammenhang:
Die freiwerdende Energie ist dabei proportional dem Volumen des Keims, wohingegen die aufzuwendende Energie seiner Oberfläche proportional ist. Geht man von einem kugelförmigen Keim mit dem Radius r aus, ergibt sich für die obenstehende Beziehung:
Dabei stellt die freie Volumenenthalpie des Keims beim Phasenübergang dar und steht für die Oberflächenspannung der Schmelze. Bei der Betrachtung dieser Beziehung fällt auf, dass zunächst Energie aufgebracht werden muss, um einen Keim zu erzeugen. Erst wenn durch zufällige Konvergenz ein Keim entsteht, dessen Radius größer als der kritische Keimradius ist, kann dieser wachsen und seine freie Enthalpie dadurch minimieren. Keime, deren Radius kleiner als ist, minimieren ihre Enthalpie, indem sie sich wieder auflösen.[2]
Heterogene Keimbildung
Heterogene Keimbildung ist ein Vorgang, bei dem die Keimbildung durch die Anwesenheit eines Fremdkeims in der Schmelze erleichtert wird. Sie ist wesentlich häufiger anzutreffen als die homogene Keimbildung, da die erstere nicht in so großem Maße von der zufälligen Anwesenheit der notwendigen Bestandteile eines Keims abhängig ist. Durch die Gegenwart eines genügend großen Keims ist bereits ein Teil der zu erbringenden Grenzflächenenergie erbracht worden. Im Extremfall kann man diesen Vorgang als ein Aufwachsen eines Kristalls auf einen Fremdkristall in der Schmelze verstehen. Dieser Vorgang wird Epitaxie genannt und wird beispielsweise gezielt genutzt, um Glaskeramiken herzustellen.
Kristallisation in der Glasproduktion
Im Allgemeinen wird Entglasung als Glasfehler angesehen, der – etwa in einer Glasschmelze in Bereichen mit geringer Strömung der Schmelze oder in besonders anfälligen Gläsern (wie etwa solche mit hohem Erdalkalioxid-Gehalt, CaO oder MgO) – sowohl beim Abkühlen der Glasschmelze, als auch beim Erhitzen von Gläsern auftreten kann. Erhöhte Gehalte an Erdalkalioxiden erhöhen in den meisten Massengläsern die Liquidustemperatur, so dass eine Kristallisation bei höheren Temperaturen, wie sie beispielsweise in Speisern vorkommen, einsetzen kann. Eine Entglasung wird in der Glasverarbeitung (als Bottom-up-Kristallisation) aber auch als gesteuerter Vorgang zur Herstellung eines gewünschten Farbglases, einer Glaskeramik oder auch eines Trübglases eingesetzt.[1]
Literatur
- Werner Vogel: Glaschemie. 3. Auflage. Springer, Berlin 1992, ISBN 3-540-55171-9.
- Armin Petzold: Anorganisch-nichtmetallische Werkstoffe. 2. Auflage. Deutscher Verlag für Grundstoffindustrie, Leipzig 1986, DNB 870224441.
- Hans Jebsen-Marwedel, Rolf Brückner (Hrsg.): Glastechnische Fabrikationsfehler. 4. Auflage. Springer, Berlin 2011, ISBN 978-3-642-16432-3.
Einzelnachweise
- Eintrag zu Entglasung. In: Römpp Online. Georg Thieme Verlag, abgerufen am 9. Februar 2013.
- Werner Vogel: Glaschemie. 3. Auflage. Springer-Verlag, 1992, ISBN 3-540-55171-9, S. 319 ff.
- Werner Vogel: Glaschemie. 3. Auflage. Springer-Verlag, 1992, ISBN 3-540-55171-9, S. 226.