Dinickelborid
Dinickelborid ist eine anorganische chemische Verbindung des Nickels aus der Gruppe der Boride. Andere, weniger häufige Nickelboride sind NiB, Ni3B, o-Ni4B3, m-Ni4B3 und Ni7B3.[4]
| Kristallstruktur | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
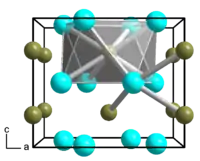 | ||||||||||||||||
| _ Ni _ B Metall-Metallbindungen sind nicht eingezeichnet | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Dinickelborid | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Verhältnisformel | Ni2B | |||||||||||||||
| Kurzbeschreibung |
grauer Feststoff[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 128,19 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest[1] | |||||||||||||||
| Dichte |
7,9 g·cm−3[2] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Löslichkeit |
nahezu unlöslich in Wasser und den meisten organischen Lösungsmitteln[3] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Gewinnung und Darstellung
Dinickelborid kann durch Reaktion von Nickel(II)-acetat mit Natriumborhydrid in Ethanol gewonnen werden.[3] Allgemein sind Nickelboride schon seit dem ersten Drittel des vorigen Jahrhunderts bekannt. Die Darstellung erfolgte mittels klassischer, festkörperchemischer Synthesewege bei hohen Temperaturen (von 700 bis ca. 2500 °C) aus den Elementen. Bei diesen Temperaturen werden kristalline Pulver oder Einkristalle erhalten.[5]
Eigenschaften
Dinickelborid ist ein grauer Feststoff.[1] Er besitzt eine tetragonale Kristallstruktur mit der Raumgruppe I4/mcm (Raumgruppen-Nr. 140) und den Gitterparametern a = 4,99 Å und c = 4,24 Å.[6][7] In der Kristallstruktur, die dem Cu2Al-Typ entspricht, ist jedes Boratom quadratisch-antiprismatisch von acht Nickelatomen umgeben, jedes Nickelatom tetragonal-pyramidal von vier Boratomen.
Verwendung
Dinickelborid wird als selektiver Hydrierkatalysator (z. B. zur Entschwefelung), zur Reduzierung von Nitro- und anderen funktionellen Gruppen, als Dehalogenierungskatalysator und als Hydrogenolysekatalysator verwendet.[3][8] Es ist auch ein Bestandteil von Legierungen und wird zur Beschichtung von Metallen und Keramik eingesetzt.[9]
Verwandte Verbindungen
- NiB: silbergrauer bis grüner Feststoff, Dichte 7,39 g/cm3, Schmelzpunkt 1080 °C, Raumgruppe Cmcm (Raumgruppen-Nr. 63), CAS-Nummer: 12007-00-0[2][6]
- Ni3B: Dichte 8,17 g/cm3, Schmelzpunkt 1155 °C, Raumgruppe Pnma (Raumgruppen-Nr. 62), CAS-Nummer: 12007-02-2[2][6]
- Ni4B3: Raumgruppe Pnma (Raumgruppen-Nr. 62) (Dichte 7,57 g/cm3) oder Raumgruppe C2/c (Raumgruppen-Nr. 15) (Dichte 7,42 g/cm3)[5]
- Ni7B3: Nur stabil zwischen 300 und 424 °C, Raumgruppe P63mc (Raumgruppen-Nr. 186)[4]
Einzelnachweise
- Eintrag zu Dinickelborid in der GESTIS-Stoffdatenbank des IFA, abgerufen am 23. Juli 2016. (JavaScript erforderlich)
- Dale L. Perry: Handbook of Inorganic Compounds, Second Edition. CRC Press, 2016, ISBN 978-1-4398-1462-8, S. 288 (eingeschränkte Vorschau in der Google-Buchsuche).
- Thomas J. Caggiano, Sylvain Taillemaud: Encyclopedia of Reagents for Organic Synthesis. John Wiley & Sons, Ltd, 2001, ISBN 978-0-470-84289-8, Nickel Boride.
- Kathrin Hofmann, Nalan Kalyon, Christine Kapfenberger, Leo Lamontagne, Salman Zarrini, Robert Berger, Ram Seshadri, Barbara Albert: Metastable Ni7B3 : A New Paramagnetic Boride from Solution Chemistry, Its Crystal Structure and Magnetic Properties . In: Inorganic Chemistry. 54, 2015, S. 10873, doi:10.1021/acs.inorgchem.5b01929.
- Universität Hamburg: Dissertation von Christine Kapfenberger Synthese und Charakterisierung von nano-skaligen Nickelboriden (Memento vom 12. Juni 2007 im Internet Archive), Dezember 2005, urn:nbn:de:gbv:18-27867, abgerufen am 3. Juli 2016
- Joseph R. Davis: Nickel, Cobalt, and Their Alloys. ASM International, 2000, ISBN 978-0-87170-685-0, S. 332 (eingeschränkte Vorschau in der Google-Buchsuche).
- N.V. Chandra Shekar, M. Sekar, P.Ch. Sahu: Equation of state and compressibility of nickel semiboride. In: Physica B: Condensed Matter. 443, 2014, S. 95, doi:10.1016/j.physb.2014.03.015.
- M.H. Rei, L.L. Sheu, Y.Z. Chen: Nickel boride catalysts in organic synthesis. I: A new ferromagnetic catalyst from the diborane reduction of nickel acetate. In: Applied Catalysis. 23, 1986, S. 281, doi:10.1016/S0166-9834(00)81298-1.
- Eintrag zu Nickelboride. In: Römpp Online. Georg Thieme Verlag, abgerufen am 3. Juli 2016.


